题目内容
【题目】关于Na2CO3 与NaHCO3的性质判断正确的是![]()
![]()
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度盐酸反应的剧烈程度:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
【答案】D
【解析】
A.在常温下Na2CO3比NaHCO3更容易溶解在水中,所以溶解度:Na2CO3>NaHCO3,A错误;
B. Na2CO3稳定,受热不分解,而NaHCO3不稳定,受热分解,所以热稳定性:Na2CO3>NaHCO3,B错误;
C. Na2CO3与盐酸反应分步进行,第一步反应产生NaHCO3和NaCl,无明显现象,而NaHCO3和盐酸混合,立即反应产生CO2气体,反应现象明显,所以与同浓度盐酸反应的剧烈程度:Na2CO3<NaHCO3,C错误;
D. Na2CO3和NaHCO3都能与澄清石灰水反应,产生难溶于水的CaCO3,因此均有白色沉淀生成,D正确;
故合理选项是D。

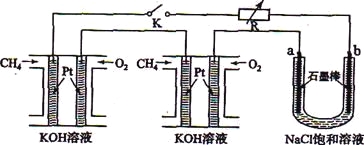
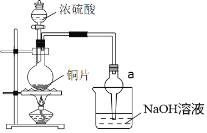
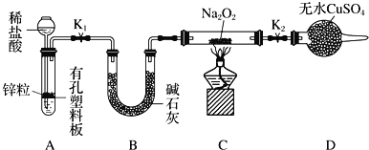
【题目】某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
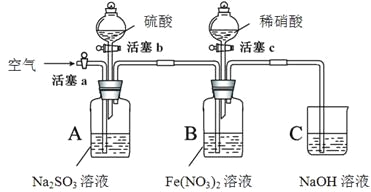
实验记录如下:
实验操作 | 实验现象 | |
I | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
II | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色。 |
III | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
IV | 一段时间后,用注射器取出少量B装置中的溶液,…… | …… |
V | 打开活塞a,通入一段时间空气 | ———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2++ NO![]() [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
【题目】某无色溶液甲中仅含有下列离子的几种( 不考虑水的电离以及离子的水解);
阳离子 | K+、Al3+、Fe3+、Ba2+、NH4+ |
阴离子 | Cl-、CO32-、HCO3-、SO42- |
取100mL溶液甲并分成两等份进行如下实验(假设每步完全反应):
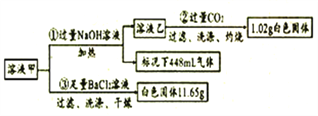
(1)由①可知,原溶液存在的离子有____,浓度为_____mol/L。
(2)写出实验②中生成沉淀的离子方程式_________。
(3)通入过量CO2充分反应后,需将反应后的混合溶液加热再过滤,其目的是_______。
(4)某同学通过分析认为该溶液中一定存在K+,其理由是________。
【题目】已知X、Y、Z均为中学化学常见物质,且均含有同一种元素,其中X是单质,它们之间的转化关系如图所示。则X、Y、Z不可能是( )

物质 选项 | X | Y | Z |
A | Na | Na2O | NaOH |
B | Fe | FeCl3 | FeCl2 |
C | Mg | Mg(OH)2 | MgO |
D | Si | SiO2 | Na2SiO3 |
A.AB.BC.CD.D