题目内容
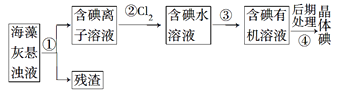
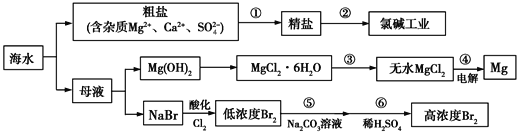
【题目】海水是一个巨大的化学资源宝库,下图是海水综合利用的部分工业流程图:
Ⅰ.在过程①中应加入的试剂分别为A.Na2CO3溶液、B.盐酸、C.BaCl2溶液、D.NaOH溶液,这4种试剂添加的合理顺序是____(填序号);过程①中须完成的实验操作分别为a.多步过滤、b.蒸发浓缩、c.冷却结晶,操作a中需要的玻璃仪器是烧杯、__________。
Ⅱ.(1)氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是____。
A.H2 B.Cl2 C.Na2CO3 D.NaOH
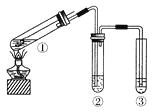
(2)如图所示是离子交换膜法电解原理示意图,两极均用惰性电极材料。精制饱和食盐水进入阳极室,H+在右电极上发生____反应(填“氧化”或“还原”),所使用的离子交换膜的主要作用是____________。

(3)操作人员欲用pH试纸测定右室溶液酸碱度,其操作方法为________。
Ⅲ.过程④制取金属镁的化学方程式为MgCl2(熔融)![]() Mg+Cl2↑。简述工业上不使用电解MgO制取金属镁的原因:___。
Mg+Cl2↑。简述工业上不使用电解MgO制取金属镁的原因:___。
Ⅳ.过程⑤用纯碱溶液吸收Br2,发生的主要反应为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,则吸收1 mol Br2,转移的电子数为____mol。
【答案】DCAB或CDAB或CADB普通漏斗和玻璃棒C还原防止OH-与Cl2反应,净化所得的NaOH溶液将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照MgO的熔点远高于MgCl2的熔点![]()
![]()
【解析】
海水晒盐后得到粗盐和母液,粗盐加入氢氧化钠、氯化钡、碳酸钠、盐酸精制除杂得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠溶液,母液中加入氢氧化钙浊液沉淀镁离子,过滤得到氢氧化镁沉淀,加入盐酸溶解后得到氯化镁溶液,蒸发浓缩,冷却结晶,过滤洗涤得到氯化镁晶体,在氯化氢气流中加热失水得到氯化镁固体,电解熔融氯化镁得到金属镁和氯气,滤液中加入氯气氧化溴离子得到溴单质的低浓度溶液,加入碳酸钠溶液吸收溴单质,再加入稀硫酸,发生归中反应得到高浓度的溴单质溶液。
Ⅰ.除去粗盐中的可溶性杂质:Ca2+、Mg2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子):Mg2++2OH-=Mg(OH)2↓,加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;也可先加氯化钡后加氢氧化钠,再加入过量Na2CO3(去除钙离子以及多余的钡离子):Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,碳酸钠必须加在氯化钡之后,盐酸在最后,除去多余的碳酸根离子,所以按滴加顺序依次为DCAB或CDAB或CADB;过程①中实验操作a中为多步过滤,需要的玻璃仪器是烧杯、普通漏斗和玻璃棒;
Ⅱ.(1)根据质量守恒定律可知化学反应前后元素的种类一定不变,反应物是氯化钠和水,所以反应后的物质中只能含有钠、氯、氢和氧四种元素。A.氢气是由氢元素组成的,符合以上关于产物情况的分析,所以氢气可能是该反应的生成物,选项A不选;B.氯气由氯元素组成,符合以上关于产物情况的分析,所以氯气可能是该反应的生成物,选项B不选;C.碳酸钠是由碳、氧和钠三种元素组成,由以上分析可知生成物中不可能含有碳元素,所以生成物中不可能含有碳酸钠,选项C选;D.氢氧化钠是由钠、氧和氢三种元素组成,符合以上关于产物情况的分析,所以可能是生成物,选项D不选。答案选C;(2)由于氯离子在左边电极上被氧化成氯气,所以精制饱和食盐水进入阳极室,右边电极连接直流电源的负极,H+在右电极上发生还原反应,所使用的离子交换膜的主要作用是防止OH-与Cl2反应,净化所得的NaOH溶液;(3)测定溶液pH的操作方法为:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
Ⅲ.由于MgO的熔点远高于MgCl2的熔点,如果电解MgO会浪费大量能源,故工业上采用电解MgCl2的方法制取金属镁;
Ⅳ.根据反应3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑可知,只有溴元素化合价发生了变化,每吸收3mol Br2,转移的电子数为5mol,则吸收1 mol Br2,转移的电子数为![]() mol。
mol。

【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。
①该反应在常温下_______(填“能”或“不能”)自发进行。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是____(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时,断裂2 mol H—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=________(取小数点后两位,下同)。
②该反应的正反应为________(
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2