题目内容
【题目】根据题意解答
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下).有机物A的实验式为;
(2)质谱仪测定有机化合物A的相对分子质量为46,A的核磁共振氢谱如图所示,则A的结构简式为; 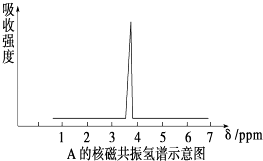
(3)A的同分异构体B属于醇,则23g B 与足量的金属钠反应产生的气体在在标准状况下的体积为L.
【答案】
(1)C2H6O
(2)CH3﹣O﹣CH3
(3)5.6
【解析】解:(1)根据质量守恒定律可知,化合物中所含C元素质量为:8.8g× ![]() =2.4g,所含H元素质量为:5.4g×
=2.4g,所含H元素质量为:5.4g× ![]() =0.6g,二氧化碳和水中的氧元素质量之和为 (8.8g﹣2.4g)+(5.4g﹣0.6g)=11.2g,而氧气的质量为
=0.6g,二氧化碳和水中的氧元素质量之和为 (8.8g﹣2.4g)+(5.4g﹣0.6g)=11.2g,而氧气的质量为 ![]() ×32g/mol=9.6g,所以有机物中氧元素质量为11.2g﹣9.6g=1.6g,n(C):n(H):n(O)=
×32g/mol=9.6g,所以有机物中氧元素质量为11.2g﹣9.6g=1.6g,n(C):n(H):n(O)= ![]() :
: ![]() :
: ![]() =2:6:1,所以化合物的实验式(最简式)是C2H6O,
=2:6:1,所以化合物的实验式(最简式)是C2H6O,
所以答案是:C2H6O;(2)因化合物的实验式(最简式)是C2H6O,所以分子式为(C2H6O)n,而有机化合物的相对分子质量为46,所以n=1,则分子式为:C2H6O,由核磁共振氢谱示意图可知化合物中有1种氢原子,结构简式为CH3﹣O﹣CH3 , 所以答案是:CH3﹣O﹣CH3;(3)A的同分异构体B属于醇,应为CH3CH2OH,n(CH3CH2OH)= ![]() =0.5mol,生成氢气的关系式为CH3CH2OH~H2 , 可生成0.25mol气氢气,体积为0.25mol×22.4L/mol=5.6L.
=0.5mol,生成氢气的关系式为CH3CH2OH~H2 , 可生成0.25mol气氢气,体积为0.25mol×22.4L/mol=5.6L.
所以答案是:5.6L.

练习册系列答案
相关题目