题目内容
(1)2NH4Cl +Ca(OH)2△2NH3↑+CaCl2 +2H2O (1分)
(2)①N2(g) +3H2(g) 2NH3(g)
2NH3(g)  H= -93.36 kJ/mol (1分)
H= -93.36 kJ/mol (1分)
②将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露。(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露。) (1分)
(3)① 200℃(1分) ② AC(1分) ③ 75%(1分)
(4)① (NH4)2SO3和NH4HSO3(1分)
② NH4+ + H2O NH3·H2O + H+ SO32-+H2O
NH3·H2O + H+ SO32-+H2O HSO3-+ OH-,SO32-水解程度大于NH4+的水解程度使溶液中c(OH-) > c(H+),溶液呈碱性。(1分)
HSO3-+ OH-,SO32-水解程度大于NH4+的水解程度使溶液中c(OH-) > c(H+),溶液呈碱性。(1分)
③ a b(2分)
(5)①碱性(1分 ②CO2(1分) ③ 4NH3+ 3O2= 2N2 + 6H2O (1分)
3O2 + 12e-+ 6H2O = 12OH-(1分)或 O2 + 4e-+ 2H2O = 4OH-
解析试题分析:(1)实验室制取氨气的化学方程式是2NH4Cl +Ca(OH)2△2NH3↑+CaCl2 +2H2O。
(2)①该反应的△H="945" kJ/mol+3×(436 kJ/mol)-6×(-391.06 kJ/mol)=-93.36 kJ/mol。
②检查氨气是否泄露有:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露。(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露。
(3)①曲线a的NH3的物质的量分数最大,而合成氨为放热反应,故对应的温度最低,是200℃。
考点:官能团为酯键的芳香化合物的性质。
②A.及时分离出NH3可以使平衡正向移动,可以提高H2的平衡转化率;
B. 加催化剂能加快反应速率,但不能破坏破坏,不能提高H2的平衡转化率;
C.合成氨为体积缩小的反应,压强越高平衡常数K越大,故K(M)=" K(Q)" >K(N)。
③N2(g) +3H2(g) 2NH3(g)
2NH3(g)
1 3 0
变化:1x 3x 2x
M点对应 =60%,H2转化率75%。
=60%,H2转化率75%。
(4)① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L即2molSO2时,溶液中的溶
质含NH 与S的个数比为3:2,故是1:1的(NH4)2SO3和NH4HSO3。
与S的个数比为3:2,故是1:1的(NH4)2SO3和NH4HSO3。
② (NH4)2SO3显碱性,是SO 水解的缘故。
水解的缘故。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,
a.因为c(NH4+)+ c(H+)= 2c(SO32-) + c(HSO3-)+ c(OH-),中性得出c(NH4+) = 2c(SO32-)+ c(HSO3-);
b.NH 为盐直接电离的离子,SO
为盐直接电离的离子,SO 是HSO
是HSO 电离的离子,即c(NH4+)> c(SO32-);
电离的离子,即c(NH4+)> c(SO32-);
c.由电荷守恒:c(NH4+)+ c(H+)="2" c(SO32-)+c(HSO3-)+c(OH-)
(5)③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体是N2和水,即4NH3+ 3O2= 2N2 + 6H2O,正极的电极反应方是O2 + 4e-+ 2H2O = 4OH-

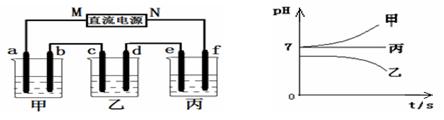
根据下图,下列判断中不正确的是( )
| A.通入O2的电极的电极反应式为:O2 + 2H2O + 4e-= 4OH- |
| B.反应一段时间后,甲池中溶液的pH降低 |
| C.乙池中电极B上发生还原反应 |
| D.当乙池中的某一电极质量增加 10.80g时, 理论上甲池中消耗的气体至少为840mL(标准状况下) |
【选修2化学与技术】(20分)
20-I(6分)下列有关叙述正确的是
| A.碱性锌锰电池中,MnO2是催化剂 | B.银锌纽扣电池工作时,Ag2O被还原为Ag |
| C.放电时,铅酸蓄电池中硫酸浓度不断增大 | D.电镀时,待镀的金属制品表面发生还原反应 |

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是____。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为____________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
(6分)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |