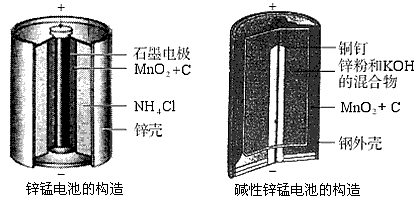
题目内容

(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:______.
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大.试从影响反应速率的因素分析其原因是______.
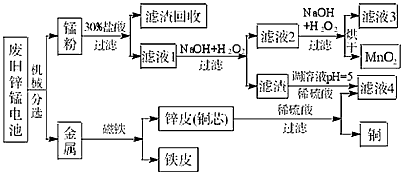
(3)某工厂回收废旧锌锰电池,其工艺流程如图二:
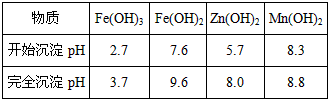
已知:生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 8.0 | 9.8 |
故答案为:Zn+2OH--2e-=Zn(OH)2;
(2)碱性锌锰电池用的是锌粉,而锌锰电池用的是锌壳,反应物的表面积大,反应速率增大,有利于增大放电电流,
故答案为:碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大;
(3)根据电池总反应可知锰粉中含有MnOOH,用30%的盐酸处理后有不溶于水的固体,应含有C粉;由表中数据可知,调节pH=8.0有利于生成Zn(OH)2和Fe(OH)3除去;滤液4中含有
Zn2+,可用于制备皓矾、回收金属锌,
故答案为:MnOOH、C粉;将Zn2+、Fe3+转化为Zn(OH)2和Fe(OH)3除去;制备皓矾、回收金属锌等.

请仔细观察两种电池的构造示意图,回答下列问题:

(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析
其原因是
(3)某工厂回收废旧锌锰电池,其工艺流程如下:

已知:生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 8.0 | 9.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2 。
②第一次加入H2O2后,调节pH=8.0。目的
是 。
③试列举滤液4的应用实
例 。
(10分)请仔细观察两种电池的构造示意图,完成下列问题:
锌锰电池的构造 碱性锌锰电池的构造
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O====2MnOOH+Zn(OH)2,则负极的电极反应式:_____________________________________。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是_____________________________________。
(3)某工厂回收废旧锌锰电池,其工艺流程如下: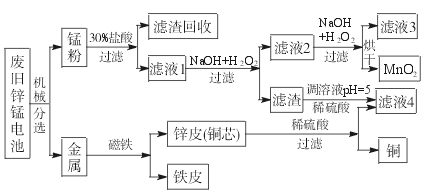
已知:生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 8.0 | 8.8 |
②第一次加入H2O2后,调节pH=8.0。目的是____________________________________。
③试列举滤液4的应用实例:____________________________________________。
(10分)请仔细观察两种电池的构造示意图,完成下列问题:

锌锰电池的构造 碱性锌锰电池的构造
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O====2MnOOH+Zn(OH)2,则负极的电极反应式:_____________________________________。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是_____________________________________。
(3)某工厂回收废旧锌锰电池,其工艺流程如下:

已知:生成氢氧化物的pH如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
8.0 |
8.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2、__________。
②第一次加入H2O2后,调节pH=8.0。目的是____________________________________。
③试列举滤液4的应用实例:____________________________________________。