题目内容
判断溶液的酸碱性有多种方法。下列溶液中,一定呈碱性的是
- A.能够使甲基橙呈现黄色
- B.溶液的pH>7
- C.溶液中:c(H+)<c(OH-)
- D.溶液中:c(H+)>1×10-7mol·L
C
A项甲基橙的变色范围是pH<3.1的变红,pH>4.4的变黄,所以能够使甲基橙呈现黄色的溶液不一定显碱性;B项,只有在室温下溶液的pH>7,溶液显碱性;C项,溶液中:c(H+)<c(OH-)溶液肯定显碱性;D项,不同温度下,溶液的离子积可能大于1×10-14mol·L所以溶液中:c(H+)>1×10-7mol·L时,溶液不一定呈碱性。
A项甲基橙的变色范围是pH<3.1的变红,pH>4.4的变黄,所以能够使甲基橙呈现黄色的溶液不一定显碱性;B项,只有在室温下溶液的pH>7,溶液显碱性;C项,溶液中:c(H+)<c(OH-)溶液肯定显碱性;D项,不同温度下,溶液的离子积可能大于1×10-14mol·L所以溶液中:c(H+)>1×10-7mol·L时,溶液不一定呈碱性。

练习册系列答案
相关题目
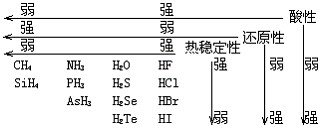
判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推断它们的结构式分别为:① ;② .
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:① ;② .
(3)在H3PO3和H3AsO3中分别加入浓盐酸,化学方程式为: ; .
请按要求回答下列问题:
(4)指出下面物质分子或离子的空间构型:PO43- ;CS2 .
(5)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子.根据下面给出的这两种微粒的球棍模型,写出相应的化学式:
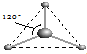 ;
;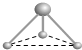 .
.
(6)按要求写出第二周期非金属元素构成的中性分子的化学式:平面形分子 ;三角锥形分子 ;四面体形分子 .
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 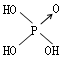 |
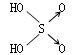 |
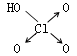 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:①
(3)在H3PO3和H3AsO3中分别加入浓盐酸,化学方程式为:
请按要求回答下列问题:
(4)指出下面物质分子或离子的空间构型:PO43-
(5)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子.根据下面给出的这两种微粒的球棍模型,写出相应的化学式:


(6)按要求写出第二周期非金属元素构成的中性分子的化学式:平面形分子





 溶液;
溶液; 饱和溶液,可以制得
饱和溶液,可以制得 胶体;
胶体; 步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;