题目内容
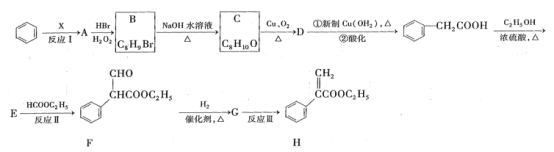
【题目】焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和H2O。
(1)写出并配平该反应的方程式____;
(2)发生氧化反应的物质是___,反应中4mol的氧化剂能得到___mol电子;
(3)反应中产生了11.2L(标准状况)的气体时,被还原的物质的质量为___g;
(4)向NH4Cl溶液中滴加NaOH溶液并加热会放出气体,发生反应的离子方程式为_____。
【答案】4Fe2O3 +6NH4Cl![]() 2FeCl3+6Fe+3N2↑+12H2O NH4Cl 18 80 NH4++OH—
2FeCl3+6Fe+3N2↑+12H2O NH4Cl 18 80 NH4++OH—![]() NH3↑+H2O
NH3↑+H2O
【解析】
根据信息,用氯化铵除去铁锈,即氯化铵和Fe2O3为反应物,根据元素守恒,则N2、Fe、FeCl3、H2O为产物,NH4Cl中N的化合价由-3价→0价,Fe2O3中铁元素的化合价由+3价→0价,根据化合价升降法进行配平,据此分析;
(1)根据信息,用氯化铵除去铁锈,即氯化铵和Fe2O3为反应物,根据元素守恒,则N2、Fe、FeCl3、H2O为产物,得出Fe2O3+NH4Cl→N2+Fe+FeCl3+H2O,NH4Cl中N的化合价由-3价→0价,Fe2O3中铁元素的化合价由+3价→0价,根据化合价升降法进行配平,得出4Fe2O3+6NH4Cl ![]() 2FeCl3+6Fe+3N2↑+12H2O;
2FeCl3+6Fe+3N2↑+12H2O;
答案为4Fe2O3+6NH4Cl ![]() 2FeCl3+6Fe+3N2↑+12H2O;
2FeCl3+6Fe+3N2↑+12H2O;
(2)根据(1)的分析,N的化合价升高,NH4Cl为还原剂,发生氧化反应,该反应中Fe2O3为氧化剂,根据反应方程式,4molFe2O3参加反应时,其中有1molFe2O3没有参与氧化还原反应,3molFe2O3作氧化剂时,得到电子物质的量为3mol×2×3=18mol;
答案为NH4Cl;18;
(3)生成气体的物质的量为![]() =0.5mol,被还原的物质是Fe2O3,根据反应方程式,3molFe2O3被还原的同时有3molN2生成,即被还原的物质的量为0.5mol×160g·mol-1=80g;
=0.5mol,被还原的物质是Fe2O3,根据反应方程式,3molFe2O3被还原的同时有3molN2生成,即被还原的物质的量为0.5mol×160g·mol-1=80g;
答案为80g;
(4)向NH4Cl溶液中滴加NaOH溶液并加热,发生NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
答案为NH4++OH-![]() NH3↑+H2O。
NH3↑+H2O。

【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
【题目】(1)在氧化还原反应中,氧化剂__电子,发生的反应是__反应;还原剂__电子,发生的反应是__反应。铁与氯气反应的方程式为2Fe+3Cl2![]() 2FeCl3,生成物中铁是__价,铁与盐酸的反应式为___,生成物中铁是__价,这一事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)___。
2FeCl3,生成物中铁是__价,铁与盐酸的反应式为___,生成物中铁是__价,这一事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)___。
(2)0.6mol的氧气与0.4mol臭氧O3质量之比为___,分子个数之比为___,氧原子个数之比为___。
(3)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是:___。
(4)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A.B两组,而且每组中均含两种阳离子和两种阴离子。
A组:___;B组:____。