题目内容
Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a 。
(2)将装置C中两种液体分离开的操作名称是 。装置D的作用是 。
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
已知CaO2·8H2O呈白色,微溶于水。I2+2S2O32-= 2I-+S4O62-
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
①判断此滴定实验达到终点的方法是: 。
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”)。
(1)d e f (2分)
(2)分液(2分) ;吸收多余的NH3防止污染空气,防止倒吸(2分)
Ⅱ、(1)CaCl2+H2O2+2NH3+8H2O = CaO2·8H2O↓+2NH4Cl (2分)
(2)取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀。(2分)
(3)①当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色(2分)
② 或
或 (2分) ③偏高(1分),
(2分) ③偏高(1分),
解析试题分析:(1)A是制备氨气,经过C吸收,d进e 出,进入f吸收尾气,答案:d e f ;(2分)
(2)C中CCl4是有机物,上层是(NH4)2SO4溶液,分两层,应用分液法分离,D中盛水,NH3极易溶于水,D的作用是吸收多余的NH3防止污染空气,防止倒吸。答案:分液(2分);吸收多余的NH3防止污染空气,防止倒吸(2分)
Ⅱ、(1)根据流程图反应物是CaCl2、H2O2、NH3、H2O 生成物是CaO2·8H2O、NH4Cl ,答案:CaCl2+H2O2+2NH3+8H2O = CaO2·8H2O↓+2NH4Cl 或CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl;(2分)
(2)CaO2·8H2O表面可能有NH4Cl,可以检验产品中是有Cl― ,答案:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀。(2分)
(3)①CaO2具有强氧化性,溶液中加入KI晶体和淀粉溶液,生成的碘单质遇淀粉变蓝色,反应的离子方程式为:CaO2+4H++2I-═Ca2++2H2O+I2,答案:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色(2分)
② 根据反应的离子方程式,CaO2+4H++2I-═Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,可得关系式并以此进行计算:
CaO2~2S2O32-
72g 2mol
m cV×10-3mol
m=
=36cV×10-3g
则CaO2的质量分数为 或
或 ;
;
答案:  或
或 (2分)
(2分)
③ 空气中的氧气也可能使I―氧化,导致所耗标准液增多,CaO2的质量分数可能偏高,答案:偏高(1分),
考点:物质分离和提纯的方法和基本操作综合应用

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。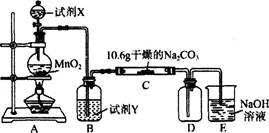
(1)写出装置A中发生反应的离子方程式:
(2)写出试剂Y的名称:_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分: NaHCO3和__________
假设二:存在三种成分: NaHCO3和__________、___________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
| 步骤2:向A试管中滴加______________: | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
| 步骤3:向B试管中滴加______________: | 若溶液变浑浊,结合步骤2中的①,则假设 一成立:结合步骤2中的②,则假设二成立。 |
(4)己知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH﹣)-c(H+)=___________(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有______________________。
将一定量铁粒放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。
(1)为探究溶液X中铁元素的价态,设计如下实验:
药品和仪器:0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性高锰酸钾溶液、氯水、试管和滴管。
请根据实验设计,填写下列实验报告:
| 实验步骤 | 实验操作 | 现象与结论 | 离子方程式 |
| 第1步 | 取2~3mL溶液装于试管,向试管中滴加几滴KSCN溶液 | | |
| 第2步 | | 若溶液紫色褪去,则溶液 含有Fe2+;若无明显变化, 则不含Fe2+ | |
为探究Cl2、漂白粉的制备及有关性质,某兴趣小组设计并进行了以下实验探究。请回答以下问题:
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→_______、_______→_______、_______→_______;其中广口瓶Ⅱ中的试剂为_______。

(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式_______;
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定存在CaCl2。请设计实验,探究该样品中除CaCl2外还含有的其他固体物质。
①提出合理假设。
假设1:该漂白粉未变质,还含有Ca(ClO)2
假设2:该漂白粉全部变质,还含有______;
假设3:该漂白粉部分变质,还含有Ca(ClO)2和CaCO3。
②设计实验方案,进行实验。请在下表中写出实验步骤、预期现象和结论。
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、品红溶液、1 mol·L-1 HCl溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-。)
| | 实验步骤 | 预期现象与结论 |
| 步骤1 | 取少量上述漂白粉于试管中,先加入 溶解后,再把生成的气体通入 。 | 若 ,则假设1成立; 若 ,则假设2或假设3成立。 |
| 步骤2 | 已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1 mol·L-1 HCl溶液,再加入 。 | 若 ,则假设2成立; 若 ,则假设3成立。 |
海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)
| A.Cl2 | B.淡水 | C.烧碱 | D.食盐 |
(3)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是________,
 转化为MgCl2的离子方程式是________________________________。
转化为MgCl2的离子方程式是________________________________。②由无水MgCl2制取Mg的化学方程式是________________________。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是________________。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式____________________________。
反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈________色。


 2CuSO4+2H2O ) ,于是他提出了另一套方案:
2CuSO4+2H2O ) ,于是他提出了另一套方案:

