题目内容
4.下列与化学反应能量变化相关的叙述正确的是( )| A. | 生成物能量一定低于反应物总能量 | |
| B. | 放热反应不必加热就一定能发生 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
分析 A、反应分为吸热反应和放热反应;
B、有些放热反应也需要加热才能发生;
C、CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变;
D、反应的焓变只和反应物生成物的能量有关,与反应途径、条件无关.
解答 解:A、反应分为吸热反应和放热反应,吸热反应的反应物的总能量小于生成物的总能量,而放热反应的反应物的总能量大于生成物的总能量,故A错误;
B、有些放热反应也需要加热才能发生,如煤炭的燃烧,需要先加热才能进行,故B错误;
C、CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变,故C正确;
D、△H=Q(生成物的能量和)-Q(反应物的能量和),与反应途径、反应条件无关,故D错误.
故选C.
点评 本题虽难度不大,但考查范围广,考查知识基础、全面,是一道好题,符合现在的高考思路.

练习册系列答案
相关题目
14.在2L密闭容器中,盛有2mol X和2molY物质进行如下反应:X(s)+3Y(g)?Z(g),当反应进行到10s后,测得生成0.5mol Z,这期间的平均反应速率为( )
| A. | v(X)=0.5mol•s-1 | B. | v(X)=0.025mol•L-1•s-1 | ||
| C. | v(y)=0.05mol•L-1•s-1 | D. | v(y)=0.075mol•L-1•s-1 |
15.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2$\stackrel{催化剂}{→}$CO2+H2O.下列有关说法正确的是( )
| A. | 该反应为放热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中只含δ键不含π键 | D. | 设生成1.8gH2O消耗2.24L O2 |
12.下列气体的主要成分不是甲烷的是( )
| A. | 坑道气 | B. | 煤气 | C. | 天然气 | D. | 沼气 |
9.将N2和H2的混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后反应速率为:v甲(H2)=3mol•L-1•min-1,v乙(N2)=2mol•L-1•min-1,v丙(NH3)=1mol•L-1•min-1.这段时间内三个容器中合成氨的反应速率的大小关系为( )
| A. | v甲>v乙>v丙 | B. | v乙>v甲>v丙 | C. | v甲>v丙>v乙 | D. | v甲=v乙=v丙 |
13.属于氮的固定的是( )
| A. | 植物从土壤中吸收含氮养料 | |
| B. | 豆科植物把含氮化合物转变为蛋白质 | |
| C. | 将空气中的氮气转化为含氮化合物 | |
| D. | NH3经催化氧化生成NO |
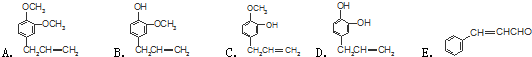
 $\stackrel{反应②}{→}$X,
$\stackrel{反应②}{→}$X,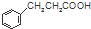 .
. 甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.