题目内容
常温下A和B两种气体组成混合气体(A的式量大于B的式量).经分析,混合气体中只含氮和氢两种元素,而且不论A,B以何种比例混合,氮和氢的质量比总大于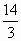 ,则A为________,B为________,其理由是________.若上述混合气体中氮和氢的质量比为7∶1,则在混合气体中A和B的物质的量之比为________,A在混合气体中的体积分数为________.
,则A为________,B为________,其理由是________.若上述混合气体中氮和氢的质量比为7∶1,则在混合气体中A和B的物质的量之比为________,A在混合气体中的体积分数为________.
答案:
解析:
解析:
|
N2,NH3,纯NH3中N和H的质量比为14/3,只有混入N2才能使N,H质量比总大于14/3,又因A的式量大于B的式量,故A为N2,B为NH3,1∶4,20% 导解:若混合气中N,H质量比为7∶1,则设N2为x mol,NH3为y mol,则有(28x+14y)/3y=7∶1,求得x∶y=1∶4.故A在混合气体中的体积分数为 |

练习册系列答案
相关题目
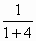 ×100%=20%.
×100%=20%. 。由此可确定A为______,B为______,其理由是________________。若上述混合气体中氮和氢的质量比为7:1,则在混合气中A 和B的物质的量之比为__________,A在混合气中的体积分数为_______________。
。由此可确定A为______,B为______,其理由是________________。若上述混合气体中氮和氢的质量比为7:1,则在混合气中A 和B的物质的量之比为__________,A在混合气中的体积分数为_______________。