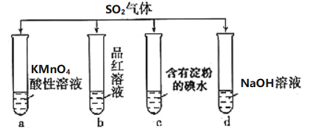
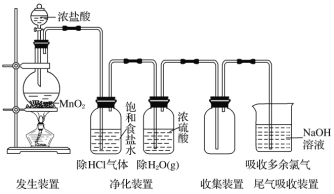
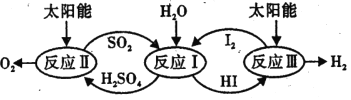
题目内容
【题目】在两只锥形瓶中分别加入浓度均为l molL-1 的盐酸和NH4Cl溶液,将温度和pH 传感器与溶液相连,往瓶中同时加入过量的质量、形状均相同的镁条,实验结果如下图。关于该实验的下列说法,正确的是

A.P点溶液:c(NH4+) + 2c(Mg2+) >c(Cl-)
B.反应剧烈程度:NH4Cl >HCl
C.Q点溶液显碱性是因为MgCl2发生水解
D.1000s后,镁与NH4Cl溶液反应停止
【答案】A
【解析】
浓度均为l molL-1的盐酸和NH4Cl溶液中加入过量的质量、形状均相同的镁条,反应的实质都是Mg+2H+==Mg2++H2↑,从图中可以看出,反应初期,盐酸与镁反应速率快,放出的热量多。反应一段时间后,NH4Cl溶液的pH迅速上升,然后基本恒定;盐酸溶液的pH缓慢上升,当反应时间接近3000s时,pH才迅速上升,然后保持恒定。
A.从图中可以看出,P点溶液的pH>7,此时c(OH-)>c(H+);依据电荷守恒可知,c(NH4+) + 2c(Mg2+)+c(H+)=c(Cl-)+ c(OH-),所以c(NH4+) + 2c(Mg2+) >c(Cl-),A正确;
B.镁与盐酸反应,溶液温度迅速升高,并达最高点,反应放出的热量多,所以反应剧烈程度:HCl >NH4Cl,B不正确;
C.MgCl2水解时,溶液显酸性,所以Q点溶液显碱性不是MgCl2发生水解所致,C不正确;
D.1000s后,镁与NH4Cl溶液反应温度仍在缓慢上升,溶液的pH仍在缓慢增大,说明反应仍在正向进行,D不正确;
故选A。

 阅读快车系列答案
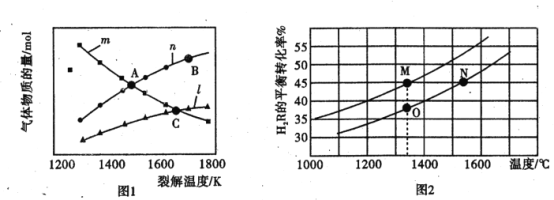
阅读快车系列答案【题目】T℃时,在2L的密闭容器中,气体X、Y、Z的物质的量随时间的变化曲线如图所示。
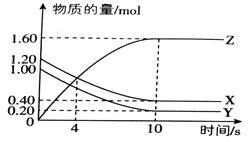
(1)该反应的化学方程式为_________________________.
(2)0~10s内,X的化学反应速率为___________________.
(3)该反应在不同温度下的平衡常数如表所示:
T/℃ | 100 | 220 | 830 | 1000 | 1200 |
K | 45.00 | 32.00 | 1.00 | 0.60 | 0.38 |
则该反应的ΔH__________0 (填“>”、“<”或“=”)
(4)830℃时,在容积为10L的恒容密闭容器中充入5molX气体、7.8molY气体和7.1mol Z气体,此时υ(正)_______υ(逆) (填“>”、“<”或“=”)
(5)上图所示反应的温度为_________________。