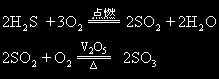题目内容
无色气体A在空气中完全燃烧生成气体B,B在一定条件下氧化生成C;A、B、C溶于水所得溶液均为酸性,而且酸性逐渐增强;将A、B所得溶液与过量溴水反应,可见溴水的橙色褪去,得到无色溶液为强酸性。若将A与B混合时,会有淡黄色固体生成;A与C混合,同样有淡黄色固体生成。根据上述实验事实,推断A、B、C各是何种物质,并写出相关的化学方程式。
答案:
解析:
提示:
解析:
气体A是H2S,气体B是SO2,物质C是SO3。它们相互转化的化学方程式是:
H2S溶于水得氢硫酸,SO2溶于水得亚硫酸,SO3溶于水得硫酸 SO2+H2O SO3+H2O=H2SO4 H2S、H2SO3被过量溴水氧化的化学方程式是: H2S+4Br2+4H2O=H2SO4+8HBr H2SO3+Br2+H2O=H2SO4+2HBr H2S与SO2、H2S与SO3发生氧化还原反应生成的硫黄的化学方程式是: 2H2S+SO2=3S+2H2O 3H2S+SO3=4S+3H2O
|
提示:
依据题意整理出的上述关系网络,说明气体A是可燃性气体,其燃烧产物气体B与A含有同种元素,且价态较高,B的氧化产物C与A也含有同种元素,且处于高价态;从A、B、C溶于水得到的酸A是弱酸,酸B是中强酸,酸C是强酸,且酸A、酸B均可被过量溴水氧化为强酸性的无色溶液,可初步判断气体A为气态氢化物,气体B为处于中间价态的氧化物,物质C是高价氧化物。 本题给出的另一条线索是:
说明A具有强还原性,A、B、C所含的同种元素是硫元素,从而找出解答本题的突破口,确定A是硫化氢,B是二氧化硫,C为三氧化硫,酸A是氢硫酸,酸B是亚硫酸,酸C是硫酸,黄色固体是硫黄。
|

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目