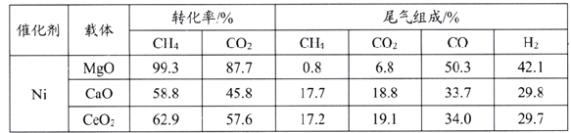
题目内容
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐增大
D.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
【答案】D
【解析】
A.同主族元素最高价含氧酸自上而下酸性减弱,不是最高价,含氧酸的酸性不一定减弱,如HClO为弱酸、HBrO4为强酸,A选项错误;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2离子具有强还原性,B选项错误;
C.电子排布相同的微粒,原子序数越大,半径越小,则S2-、Cl、K+、Ca2+半径逐渐减小,C选项错误;
D.同位素的化学性质相同,![]() Cl与
Cl与![]() Cl互为同位素,所以它们形成的单质的化学性质相同,即
Cl互为同位素,所以它们形成的单质的化学性质相同,即![]() Cl与
Cl与![]() Cl得电子能力相同,D选项正确;
Cl得电子能力相同,D选项正确;
答案选D。

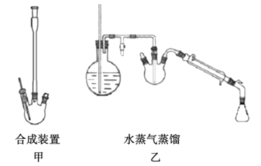
【题目】某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示装置时行实验:
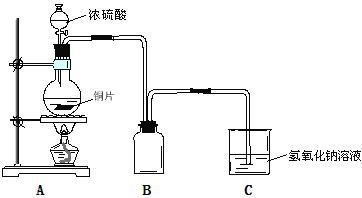

(1)B是用来收集实验中产生的气体的装置,装置图补充完整后正确的是__________;

(2)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
① 请写出铜跟浓硫酸反应的化学方程式:_____________________________________。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是___________(填写字母编号)。
A.硫酸钠溶液 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为原因是__________________________。
(3)为了确定反应生成的主要气体成分,还可以在实验装置A和B之间补充以上右图D装置,其中洗气瓶中可以盛有__________(试剂)。