题目内容
下列叙述中正确的是( )
| A、下列物质都属于原子晶体:硅晶体、玻璃、干冰、光导纤维、汞、氯化钠 | B、同主族元素的单质的熔点都随原子序数的增加而升高 | C、下列晶体的熔点的高低关系是:MgO>NaCl>Na>Hg>HF>HCl | D、固态、液态都不导电的物质形成的晶体都是分子晶体 |
分析:A.由分子构成为晶体为分子晶体;由原子构成的晶体为原子晶体;由离子构成的晶体为离子晶体;由金属阳离子和自由电子构成的晶体为金属晶体;
B.卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低;
C.比较固体物质的熔点时,首先是区分各晶体的类型:MgO,NaCl为离子晶体,Na,Hg为金属晶体,HF,HCl为分子晶体,这几类晶体的熔点高低一般为:原子晶体>离子晶体>金属晶体>分子晶体;在离子晶体中,离子的半径越小,阴、阳离子所带电荷越多,晶格能越大,则晶体的熔点越高;金属晶体中金属离子半径越小,电荷数越多,其熔沸点越高;在组成结构均相似的分子晶体中,式量大的分子间作用力就大,熔沸点高;分子极性大,熔沸点高;但分子间有氢键存在的物质熔沸点偏高;
D.固态、液态都不导电的物质形成的晶体可能分子晶体,也可能是原子晶体.
B.卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低;
C.比较固体物质的熔点时,首先是区分各晶体的类型:MgO,NaCl为离子晶体,Na,Hg为金属晶体,HF,HCl为分子晶体,这几类晶体的熔点高低一般为:原子晶体>离子晶体>金属晶体>分子晶体;在离子晶体中,离子的半径越小,阴、阳离子所带电荷越多,晶格能越大,则晶体的熔点越高;金属晶体中金属离子半径越小,电荷数越多,其熔沸点越高;在组成结构均相似的分子晶体中,式量大的分子间作用力就大,熔沸点高;分子极性大,熔沸点高;但分子间有氢键存在的物质熔沸点偏高;
D.固态、液态都不导电的物质形成的晶体可能分子晶体,也可能是原子晶体.
解答:解:A.干冰由分子构成为晶体,为分子晶体;硅晶体、光导纤维由原子构成的晶体,为原子晶体;玻璃、氯化钠由离子构成的晶体,为离子晶体;汞由金属阳离子和自由电子构成的晶体,为金属晶体,故A错误;
B.卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低,故B错误;
C.在离子晶体中,离子的半径越小,阴、阳离子所带电荷越多,晶格能越大,则晶体的熔点越高,熔点:MgO>NaCl;金属晶体中金属离子半径越小,电荷数越多,其熔沸点越高,熔点:Na>Hg;HF分子间有氢键存在的物质熔沸点偏高,熔点:HF>HCl,熔点高低一般为:原子晶体>离子晶体>金属晶体>分子晶体,所以熔点:
MgO>NaCl>Na>Hg>HF>HCl,故C正确;
D.固态、液态都不导电的物质形成的晶体也可能是原子晶体,如二氧化硅,故D错误;
故选:C.
B.卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低,故B错误;
C.在离子晶体中,离子的半径越小,阴、阳离子所带电荷越多,晶格能越大,则晶体的熔点越高,熔点:MgO>NaCl;金属晶体中金属离子半径越小,电荷数越多,其熔沸点越高,熔点:Na>Hg;HF分子间有氢键存在的物质熔沸点偏高,熔点:HF>HCl,熔点高低一般为:原子晶体>离子晶体>金属晶体>分子晶体,所以熔点:
MgO>NaCl>Na>Hg>HF>HCl,故C正确;
D.固态、液态都不导电的物质形成的晶体也可能是原子晶体,如二氧化硅,故D错误;
故选:C.
点评:本题主要考查了晶体的类型与熔点的关系,难度不大,掌握对应规律即可解答.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
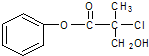 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


