题目内容
14.能用酒精灯直接加热的仪器是( )| A. | 量筒 | B. | 坩埚 | C. | 蒸发皿 | D. | 容量瓶 |
分析 实验室中,能够直接加热的仪器有:试管、燃烧匙、蒸发皿和坩埚等;需要垫石棉网的是:烧杯、烧瓶、锥形瓶等;不能加热的仪器有:漏斗、量筒、集气瓶等,据此进行解答.
解答 解:A.量筒只能用于量取液态体积,是不能加热的仪器,故A错误;
B.可在坩埚中直接灼烧固体,故B正确;
C.可直接蒸发皿,以便蒸发掉溶剂获得固体,故C正确;
D.容量瓶是配制一定物质的量浓度的溶液的仪器,不能加热,故D错误;
故选BC.
点评 本题考查了常见仪器的使用方法,题目难度不大,明确常见仪器构造及正确使用方法为解答关键,注意掌握能够加热和不能加热的仪器名称,试题培养了学生的化学实验能力.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
4.甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景.
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
则x=1076.
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.
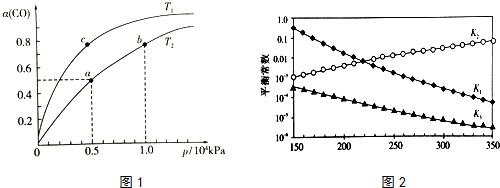
①a、b两点的反应速率:v(a)<v(b)(填“>”“<”或“=”).
②T1<T2(填“>”“<”或“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
Ⅰ:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.
则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+
△H2,所以△H1<△H3..
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.

①a、b两点的反应速率:v(a)<v(b)(填“>”“<”或“=”).
②T1<T2(填“>”“<”或“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
Ⅰ:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.
则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+
△H2,所以△H1<△H3..
5.运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
(1)请配平以下化学方程式:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
若反应过程中转移5mol电子,则生成标准状况下N2的体积为11.2L.
(2)25℃时,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为a.
a.盐酸不足,氨水剩余b.氨水与盐酸恰好完全反应c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式2H++SO42-+Ba2++2OH-=BaSO4+2H2O.
(4)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c(SO{\;}_{3}{\;}^{2-})c(H{\;}^{+})}{c(HSO{\;}_{3}{\;}^{-})}$.
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)请配平以下化学方程式:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
若反应过程中转移5mol电子,则生成标准状况下N2的体积为11.2L.
(2)25℃时,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为a.
a.盐酸不足,氨水剩余b.氨水与盐酸恰好完全反应c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式2H++SO42-+Ba2++2OH-=BaSO4+2H2O.
(4)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
2.体积为VmL,密度为ρg•mL-1的含有相对分子质量为M的某种物质(不含结晶水)的溶液,其中溶质为mg,其物质的量浓度为C mol/L,溶质的质量分数为W%,则下列表示正确的是( )
| A. | c=1000Wρ/M | B. | m=VρW/100 | C. | W%=cM/1000ρ% | D. | c=100m/VM |
19.用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA | |
| B. | 通常状况下,8g O2和O3的混合气体含有的分子数是0.5NA | |
| C. | 常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl- 个数为0.4NA | |
| D. | 标准状况下,11.2L He分子数为0.5NA |
6.对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是( )
| A. | K+、Na+、Cl-、NO3- | B. | K+、NO3-、OH-、HCO3- | ||
| C. | Na+、Ca2+、Cl-、HCO3- | D. | SO42-、NH4+、S2-、Na+ |
3.用酸式滴定管准确移取25.00mL,某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20mol•L-1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如表
(1)根据以上数据可以计算出盐酸的物质的量浓度为0.16 mol•L-1.
(2)在配制250mL0.20mol•L-1的氢氧化钠标准溶液时,用到的仪器除托盘天平、烧杯、玻璃棒还有250mL容量瓶、胶头滴管.
(3)以下操作造成测定结果偏高的有DE.
A.配制标准溶液的氢氧化钠固体中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10ml | 20.30ml |
| 第二次 | 0.30ml | 20.10ml |
(2)在配制250mL0.20mol•L-1的氢氧化钠标准溶液时,用到的仪器除托盘天平、烧杯、玻璃棒还有250mL容量瓶、胶头滴管.
(3)以下操作造成测定结果偏高的有DE.
A.配制标准溶液的氢氧化钠固体中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
4.下列说法正确的是( )
| A. | 3C(s)+CaC(s)?CaC2 (s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| C. | 恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)△H=-aKJ/mol,平衡时向容器中在充入一定量的NH3,重新达到平衡时a值不变 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g) (△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 |