题目内容
17.71g氯气与足量的铁反应,该反应中电子转移数目是( )| A. | 4NA | B. | 3NA | C. | 2NA | D. | NA |
分析 氯气与Fe反应生成氯化铁,根据n=$\frac{m}{M}$计算氯气物质的量,结合Cl元素化合价变化计算转移电子.
解答 解:氯气物质的量为$\frac{71g}{71g/mol}$=1mol,氯气与足量Fe反应生成氯化铁,反应中Cl元素化合价由0价变为-1价,故转移电子为1mol×2×[0-(-1)]×NAmol-1=2NA,
故选:C.
点评 本题考查氧化还原反应计算,比较基础,注意根据化合价理解氧化还原反应中电子转移、基本概念等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.在实验室中,对下列事故或药品的处理正确的是( )
| A. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| B. | 凡是给玻璃仪器加热,都要加垫石棉网,以防止仪器炸裂 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 取用化学药品时,应特别注意观察药品包装容器上的安全警示标志 |
5.某有机物的结构简式如图所示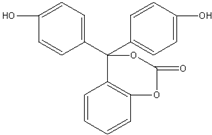 ,下列有关该有机物的说法不正确的是( )
,下列有关该有机物的说法不正确的是( )
 ,下列有关该有机物的说法不正确的是( )
,下列有关该有机物的说法不正确的是( )| A. | 该有机物的化学式为C20H14O5 | |
| B. | 该有机物分子中的三个苯环不可能共平面 | |
| C. | 该有机物可发生加成反应、取代反应、氧化反应 | |
| D. | 1mol该有机物与足量NaOH溶液充分反应,参加反应的NaOH的物质的量为6mol |
12.在醋酸溶液中,CH3COOH的电离达到平衡状态的标志是( )
| A. | c(H+)=c(CH3COO-) | |
| B. | 溶液中:c(H+)>c(OH-) | |
| C. | CH3COOH分子的浓度不再变化 | |
| D. | 溶液中同时存在H+、CH3COO-、OH-、CH3COOH、H2O |
6.常温下,氮的氧化物(NOx)中除五氧化二氮为固体外,其余均为气体.五氧化二氮的熔点为30℃,则等质量的N2O、N0、N2O5三种物质在常温下体积的大小顺序是( )
| A. | N2O>NO>N2O5 | B. | NO>N2O>N2O5 | C. | N2O5>NO>N2O | D. | N2O5>N2O>NO |