题目内容
【题目】实验室用燃烧法测定某氨基酸(CxHyOzNp)的分子组成,取w g该氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2.现用如图装置进行实验,回答问题:
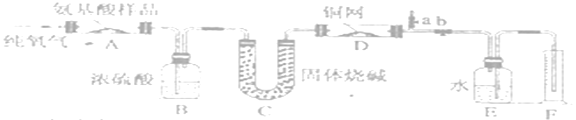
(1)实验中止水夹a是关闭的,b是开启的。但是实验开始时,首先要打开a,关闭b,通一段时间的纯氧,这样做的目的是________________________。
(2)以上装置中需要加热的有(填装置代号)_________,操作时应该先点燃_________的酒精灯。
(3)装置A中发生反应的化学方程式是________________________。
(4)为正确读取F中体积,需注意的是________________________;________________________。
(5)有一相对分子质量为88的某氨基酸取4.4g进行上述实验,测得B增重3.15g,C装置增重6.6 g,F中水的体积为560mL(已换算为标准状况),此氨基酸的分子式为_____________,属于α氨基酸的结构简式____________,该氨基酸____________(是或不是)手性分子。
【答案】 排除装置中氮气 AD D 2CxHyOzNp+![]() O2
O2![]() 2xCO2+yH2O+pN2 F和E中液面持平 读数时眼睛看凹液面 C3H7O2N CH3CH(NH2)COOH 是
2xCO2+yH2O+pN2 F和E中液面持平 读数时眼睛看凹液面 C3H7O2N CH3CH(NH2)COOH 是
【解析】试题分析:由题意知,组装好装置后,先通入氧氧排出系统内的空气,然后给D、A加热,氨基酸燃烧产生二氧化碳、水和氮气,生成物通过B后,B把水吸收,再通过C,C把二氧化碳吸收,通过灼热的铜网除去氧气后,用排水测气法测量氮气的体积,根据B、C的增重可以测量出生成物水和二氧化碳的质量。
(1)实验中止水夹a是关闭的,b是开启的。但是实验开始时,首先要打开a,关闭b,通一段时间的纯氧,这样做的目的是排除装置中氮气。
(2)以上装置中需要加热的有AD,操作时应该先点燃D的酒精灯,以保证灼热的铜网将剩余的氧气充分吸收。
(3)装置A中发生反应的化学方程式是2CxHyOzNp +![]() O2
O2![]() 2xCO2+yH2O+pN2。
2xCO2+yH2O+pN2。
(4)为正确读取F中体积,需注意的是F和E中液面持平,以保证系统内外的气压相同;读数时眼睛看凹液面,以保证读数较准确。
(5)4.4g氨基酸的物质的量为0.05mol,测得B增重3.15g,则生成水的质量为3.15g,氨基酸中含H的物质的量为![]() ;C装置增重6.6 g,则生成二氧化碳的质量为6.6 g,氨基酸中含C的物质的量为0.15mol;F中水的体积为560ml(已换算为标准状况),则生成氮气的物质的量为0.025mol,氨基酸中含N的物质的量为0.05mol,n(氨基酸):n(C):n(H):n(N)=0.05:0.15:0.35:0.05=1:3:7: 1,所以,x=3、y=7、p=1,由相对分子质量为88,求得z=2,所以此氨基酸的分子式为C3H7O2N,属于α氨基酸的结构简式CH3CH(NH2)COOH,该氨基酸含手性碳原子,所以是手性分子。
;C装置增重6.6 g,则生成二氧化碳的质量为6.6 g,氨基酸中含C的物质的量为0.15mol;F中水的体积为560ml(已换算为标准状况),则生成氮气的物质的量为0.025mol,氨基酸中含N的物质的量为0.05mol,n(氨基酸):n(C):n(H):n(N)=0.05:0.15:0.35:0.05=1:3:7: 1,所以,x=3、y=7、p=1,由相对分子质量为88,求得z=2,所以此氨基酸的分子式为C3H7O2N,属于α氨基酸的结构简式CH3CH(NH2)COOH,该氨基酸含手性碳原子,所以是手性分子。

【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:

(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ____________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
【答案】 酒精灯 Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ 吸收过量的SO2,防止污染环境 SO2+2OH- = SO32-+H2O b 溶液变红色 SO2水溶液显酸性 溶液褪色 漂白性 溶液变浑浊 氧化性 氯水褪色 还原性
CuSO4+2H2O+SO2↑ 吸收过量的SO2,防止污染环境 SO2+2OH- = SO32-+H2O b 溶液变红色 SO2水溶液显酸性 溶液褪色 漂白性 溶液变浑浊 氧化性 氯水褪色 还原性
【解析】(1)利用铜和浓硫酸制取SO2,选择固体与液体反应且需加热装置,故发生装置还需选用的仪器是酒精灯;Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;(2)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH- = SO32-+H2O;(3)SO2易溶于水,密度比空气大,选用图乙收集SO2气体,气体从b口进;(4)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色;
CuSO4+2H2O+SO2↑;(2)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH- = SO32-+H2O;(3)SO2易溶于水,密度比空气大,选用图乙收集SO2气体,气体从b口进;(4)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色;
③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性;
④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,该反应为:SO2+Cl2+2H2O═2HCl+H2SO4,实验现象为氯水褪色,二氧化硫中S元素的化合价升高被氧化,说明二氧化硫具有还原性,故答案为:
装置 | 实验现象 | 体现SO2的性质 |
① | 溶液变红色 | 二氧化硫水溶液显酸性 |
② | 溶液褪色 | 漂白性 |
③ | 溶液变浑浊 | 氧化性 |
④ | 氯水褪色 | 还原性 |
点睛:本题考查物质制备实验及性质实验,主要考查了二氧化硫的化学性质及检验方法,明确各装置的作用及发生的化学反应是解答本题的关键,注意掌握二氧化硫的性质及检验方法。综合性较强的为(4)①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③中二氧化硫与硫化氢发生氧化还原反应生成单质S;④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,据此进行解答。
【题型】实验题
【结束】
28
【题目】某课外小组准备在实验室配制95mL1.0mol/L的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制95mL1.0mol/L的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。
(2)若用10mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。
(3)配制过程中,下列操作会引起浓度偏小的是________。
A,.定容摇勾后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。

①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。
②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。
③导致红棕色气体在试管c中颜色消失的反应方程式为_________。