题目内容
19.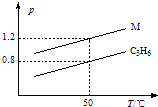 图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )
图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )| A. | SO2 | B. | CO2 | C. | C3H8 | D. | CO和N2 |
分析 同温同压下,气体的摩尔体积相等,气体的物质的量越大,则体积越大,在体积相等的容器中,气体的物质的量越大,则压强越大,结合n=$\frac{m}{M}$解答该题.
解答 解:同温同压下,气体的摩尔体积相等,在体积相等的容器中,气体的物质的量越大,则压强越大,
1g C3H6的物质的量为:$\frac{1}{42}$mol,
由图象可知在温度为50℃时,两种气体的压强之比为1.2:0.8,则物质的量之比为1.2:0.8,
设气体M的相对分子质量为x,则:$\frac{1}{42}$mol:$\frac{1g}{xg/mol}$=0.8:1.2,
解得:x=28,CO和氮气的相对分子质量都是28,只有D符合,
故选D.
点评 本题考查阿伏伽德罗定律及其推论,题目难度中等,明确图象的意义及温度相同时p与n成正比是解答本题的关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
10.化学与生活是紧密相联的,下列说法正确的是( )
| A. | 地震灾区用漂白粉消毒,是利用漂白粉溶液的碱性 | |
| B. | 铝热反应是工业炼铁常用的方法 | |
| C. | 生铁在潮湿的空气中易生锈,其负极反应式为2H2O+02+4e-═4OH- | |
| D. | 实验室储存的钠着火时,可以用砂子盖灭 |
7.某无色溶液中只可能含有①Na+、②Ba2+、③Cl一、④Br一、⑤SO32一、⑥SO42一离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:步骤操作现象
(1)用pH试纸检验溶液的pH大于7
(2)向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙红色
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生
下列结论正确的是( )
(1)用pH试纸检验溶液的pH大于7
(2)向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙红色
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生
下列结论正确的是( )
| A. | 肯定含有的离子是③④⑤ | B. | 肯定没有的离子是②⑤ | ||
| C. | 可能含有的离子是①⑥ | D. | 不能确定的离子是③⑥ |
8.下列说法正确的是( )
| A. | 酸和醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | 实验证实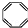 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | DDT的结构简式为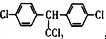 ,分子中最多有14个碳原子共平面 ,分子中最多有14个碳原子共平面 | |
| D. | 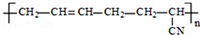 的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
9.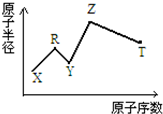 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点排序:Y>T>R | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显酸性 |