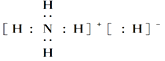题目内容
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
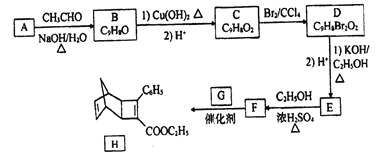
已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1) E的结构简式为_______。
(2) E生成F的反应类型为_______。
(3) 1mol化合物H最多可与_______molH2发生加成反应。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为______。
(5)芳香化合物X是F同分异构体,X能与饱和碳酸氢钠反应放出CO2,其核磁共振氢谱显示有4种不同化学环境氢,峰面积比之为6:2:1:1,写出1种符合要求的X的结构简式_____。
(6)写出用环戊烷和2-丁炔为原料制备化合物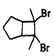 的合成路线(其他试剂任选)_____。
的合成路线(其他试剂任选)_____。
【答案】 取代反应(酯化反应) 5
取代反应(酯化反应) 5 
 或
或 或
或 或
或

【解析】
结合![]() ,由H的结构简式
,由H的结构简式 逆推可得
逆推可得
根据以上分析,(1)根据H的结构简式,逆推 F是![]() ,E与乙醇发生酯化反应生成
,E与乙醇发生酯化反应生成![]() ,则E的结构简式为
,则E的结构简式为![]() 。
。
(2) ![]() 与乙醇发生酯化反应生成
与乙醇发生酯化反应生成![]() ,反应类型为取代反应(酯化反应)。
,反应类型为取代反应(酯化反应)。
(3)碳碳双键、苯环都能与氢气发生加成反应,1mol化合物 最多可与5molH2发生加成反应。
最多可与5molH2发生加成反应。
(4)G为甲苯的同分异构体,利用逆推,可知F是![]() 、G是
、G是![]() ,生成H的化学方程式为
,生成H的化学方程式为 。
。
(5)芳香化合物X含有苯环,X能与饱和碳酸氢钠反应放出CO2,说明含有羧基,其核磁共振氢谱显示有4种不同化学环境氢,峰面积比之为6:2:1:1,说明结构对称,符合要求F的同分异构体有 或
或 或
或 或
或 ;
;
(6)环戊烷发生取代反应生成一氯环戊烷,一氯环戊烷发生消去反应生成环戊烯,环戊烯和2-丁炔发生加成反应生成![]() ,
,![]() 与溴发生加成反应生成
与溴发生加成反应生成 ,合成路线为
,合成路线为 。
。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
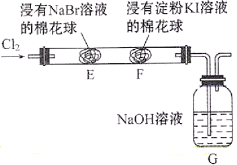
活力试卷系列答案【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含![]() 等)制备
等)制备![]() 的流程如图所示。
的流程如图所示。

已知:Ⅰ在酸性条件下,![]() 能将
能将![]() 还原为
还原为![]()
Ⅱ. ![]() 的氧化性强于
的氧化性强于![]()
Ⅲ. 相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| 4.9 | 6.8 |
| 1.5 | 2.8 |
回答下列问题:
(1)向含铬废水中加入![]() 调节
调节![]() ,目的是__________。
,目的是__________。
(2)写出“氧化”步骤中反应的例子方程式_________。
(3)“加热”操作的目的是________。
(4)“酸化”过程中发生反应![]()
![]() 已知,“酸化”后溶液中
已知,“酸化”后溶液中![]() 则溶液中
则溶液中![]() =________。
=________。
(5)“结晶”后得到![]() 产品0.3000g,将其溶解后用稀
产品0.3000g,将其溶解后用稀![]() 酸化,再由浓度为
酸化,再由浓度为![]() 标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
(6)在![]() 存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
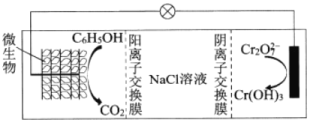
①负极的电极反应式为_________;
②处理过程中,需严格控制正极附近的pH,理由是_________
【题目】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
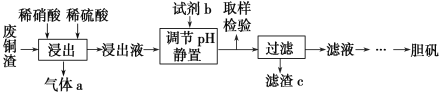
已知生成氢氧化物沉淀的pH如下表所示:
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 4.2 | 6.5 | 1.5 |
完全沉淀 | 6.7 | 9.7 | 3.7 |
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:________________。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是__________________________。
(3)试剂b是____________,滤渣c是______________(均写化学式)。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2===2NO2、 __________________。
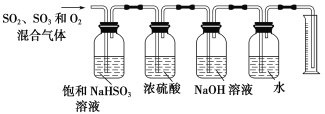
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:________________。
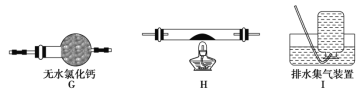
(6)某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:______________。