题目内容
1.甲基、羟基、羧基和苯基四种官能团,两两结合形成的化合物水溶液的pH小于7的有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
分析 根据化合物呈酸性的有:酚类、酸等,据此分析解答.
解答 解:由羟基、甲基、羧基、苯基四种基团中的两两结合形成的化合物为:CH3OH、H2CO3、CH3COOH、 ,其水溶液呈酸性的有碳酸、乙酸、苯甲酸,苯酚,所以共有4种;故选:B.
,其水溶液呈酸性的有碳酸、乙酸、苯甲酸,苯酚,所以共有4种;故选:B.
点评 本题考查了有机物的官能团及性质,难度不大,注意物质性质的掌握.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
13.用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变,且用惰性电极,下列说法不正确的是( )
| A. | 当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电解后c(Na2CO3)不变,且溶液中有晶体析出 | |
| D. | 电池中c(KOH)不变;电解池中溶液pH变大 |
12.丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的工艺流程如下:

(1)碱式碳酸锌与丙酸反应的化学方程式为:4CH3CH2COOH+Zn2(OH)2CO3→2Zn(CH3CH2COO)2+CO2↑+3H2O.
(2)本题采用趁热过滤的方式,其目的是:防止醋酸锌结晶析出.
(3)实验中用水量不易过少,其原因是水的用量较少时,反应不易完全,且易造成丙酸挥发损失,不利于提高产率和产品的纯度.
(4)探究本实验中最佳工艺条件(见表):反应时间2h,用水量45g,n(丙酸):n(碱式碳酸锌)=1:0.31,反应温度80℃.
(5)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为:94.0%.
(6)本工艺“采用闭路循环”方式,除具有制备工艺简便、产率高外,还具有:原料利用率高,无废液、废渣排放.

| 序号 | n(丙酸):n(碱式碳酸锌) | 反应 温度/℃ | 丙酸锌 产率/% |
| 1 | 1:0.25 | 60 | 67.2 |
| 2 | 1:0.25 | 80 | 83.5 |
| 3 | 1:0.25 | 100 | 81.4 |
| 4 | 1:0.31 | 60 | 89.2 |
| 5 | 1:0.31 | 80 | 90.1 |
| 6 | 1:0.31 | 100 | 88.8 |
(2)本题采用趁热过滤的方式,其目的是:防止醋酸锌结晶析出.
(3)实验中用水量不易过少,其原因是水的用量较少时,反应不易完全,且易造成丙酸挥发损失,不利于提高产率和产品的纯度.
(4)探究本实验中最佳工艺条件(见表):反应时间2h,用水量45g,n(丙酸):n(碱式碳酸锌)=1:0.31,反应温度80℃.
(5)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为:94.0%.
(6)本工艺“采用闭路循环”方式,除具有制备工艺简便、产率高外,还具有:原料利用率高,无废液、废渣排放.
6.下列说法中正确的是( )
| A. | 1s、2px、2py、2pz轨道都具有球对称性 | |
| B. | 因为p轨道是“8”字形的,所以p电子也是“8”字形 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个轨道 | |
| D. | 原子轨道示意图与电子云图都是用来形象描述电子运动状态的图形 |
10.欲将混合液中Al3+、Cu2+、Ba2+、Ag+逐一沉淀出来加以分离,加入试剂①Cl-②SO42- ③OH-④CO2⑤CO32-的正确顺序是( )
| A. | ①②③④ | B. | ③⑤①② | C. | ②①③⑤ | D. | ①⑤③② |
11.下列关于化学用语的表示正确的是( )
| A. | 二氟化氧分子电子式: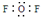 | |
| B. | 质子数与中子数相等的硫原子${\;}_{16}^{16}$S | |
| C. | 镁离子的结构示意图: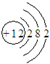 | |
| D. | 对甲基苯酚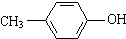 |
 某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH
某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH

 B.
B. C.
C. D.CH3CH2C≡CH与CH2═CH-CH═CH2E.
D.CH3CH2C≡CH与CH2═CH-CH═CH2E. F.戊烯和戊烷
F.戊烯和戊烷 表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3,名称是2-甲基戊烷.
表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3,名称是2-甲基戊烷.