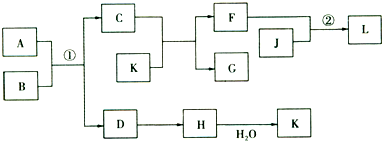
题目内容
用A、B两种常见化合物组成混合物,其焰色反应均为黄色,其相互转化关系如图(其他物质均略去)。根据以上关系,回答下列问题:
(1)写出A、B、C、D的化学式:A B C D
(2)写出混合物分别加水的化学方程式
(3)加热后,若只得到一种固体化合物,则A 与B的物质的量之比的最大值为 (填数字)
【解析】A、B均为钠的化合物,加热、加水、加酸均能产生气体,加热产生气体D。猜测可能含有碳酸钠或碳酸氢钠,加H2S04产生气体C、D.猜测有Na202,C为02.D为CO2。加水后通入C02生成B,可推测B为NaHC03。A为Na202
加热NaHC03分解产生的CO2、H20(g)都能与Na202反应.但可认为CO2优先反应:2NaHC03![]()
![]() Na2CO3+ CO2 +H20↑2CO2+ 2Na202= 2Na2CO3+ O2 要只产生Na2CO3,
Na2CO3+ CO2 +H20↑2CO2+ 2Na202= 2Na2CO3+ O2 要只产生Na2CO3,![]()
【答案】(1)有Na202,NaHC03 ,02,CO2
(2) 2Na202+2H20=4NaOH+O2↑NaHC03+NaOH=2Na2CO3+ H20
(3)![]()
![]()

练习册系列答案
相关题目
 A、B、C三种非金属元素的质子数之和为16,它们的单质在一定条件下两两化合可以生成三种常见的化合物D、E、F.D、F的一个分子中只含有10个电子,常温下D是一种液体,E是一种无色的气体.
A、B、C三种非金属元素的质子数之和为16,它们的单质在一定条件下两两化合可以生成三种常见的化合物D、E、F.D、F的一个分子中只含有10个电子,常温下D是一种液体,E是一种无色的气体. A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.