题目内容
12.氯酸是一种强酸,常温下浓度超过40%时会发生分解,反应可表示为:aHClO3→bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法正确的是( )| A. | 由反应可知化学计量数存在如下关系:2b=5c+d | |
| B. | 若化学计量数a=8,b=3,则电子数转移为20e- | |
| C. | 若氯酸分解所得的lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 变蓝的淀粉碘化钾试纸褪色是因为漂白 |
分析 A.反应中遵循电子守恒;
B.从化合价变化的角度计算转移的电子数;
C.氧化剂与还原剂得失电子数目不等;
D.变蓝的淀粉碘化钾试纸褪色,碘被氯气氧化.
解答 解:A.反应中O元素的化合价由-2价升高为0,Cl元素的化合价由+5价分别降低为0、升高为+7,由电子守恒可知c×2×(5-0)=b×2×2+d×(7-5),解得2b+d=5c,故A错误;
B.若化学计量数a=8,b=3,化学反应方程式为8HClO3=3O2↑+2 Cl2↑+4 HClO4+2H2O,还原产物只有Cl2,由HClO3→Cl2,Cl元素化合价由+5价降低为0价,故生成2molCl2时转移电子的物质的量为2mol×2×(5-0)=20mol,即该反应中电子转移数目为20e-,故B正确;
C.由生成的Cl2和O2的混合气体平均分子量为47.6g/mol,则$\frac{n({O}_{2})×32g/mol+n(C{l}_{2})×71g/mol}{n(C{l}_{2})+n({O}_{2})}$=47.6,可得n(Cl2):n(O2)=2:3,由电子守恒得化学反应方程式为:8 HClO3=3O2↑+2 Cl2↑+4 HClO4+2H2O,故C错误;
D.淀粉碘化钾试纸先变蓝是因为生成I2:2I-+Cl2=I2+2Cl-,后褪色I2被Cl2继续氧化生成IO3-:5C12+I2+6H2O=12H++10Cl-+2IO3-,故D错误;
故选B.
点评 本题考查氧化还原反应反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度较大,注意把握相关物质的性质,易错点为C,注意电子守恒问题的应用.

练习册系列答案
相关题目
7.下列所述的操作中没有涉及到化学变化的是( )
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 通过煤的液化来提取苯、二甲苯等化工原料 | |
| D. | 工业制液态氧 |
17.如表有关实验现象、解释和结论都正确的一项是( )
| 实验操作 | 实验现象 | 解释或结论 | |
| A | 加热(170℃)乙醇与浓硫酸混合物,将产生的气体直接通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液紫红色逐渐变浅 | 可能产生了SO2气体 |
| B | 取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分为两层,下层是紫红色 | KI和氯水及苯发生反应 |
| C | 将少量SO2通入苯酚钠溶液中,振荡 | 溶液中出现浑浊 | 因为发生了反应: C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D | 把浓氨水加入到盛有Cu2O的试管中 | 溶液先无色,静置一段时间后变成蓝色 | Cu+被空气氧化成了Cu2+、使溶液显蓝色 |
| A. | A | B. | B | C. | C | D. | D |
4.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA | |
| B. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
1.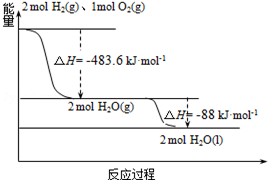 俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)=O2(l)△H2=-6.84kJ•mol-1
(3)如图:下列说法正确的是( )
 俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:(1)H2(g)=H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)=O2(l)△H2=-6.84kJ•mol-1
(3)如图:下列说法正确的是( )
| A. | 2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1 | |
| D. | H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量 |
20.固体乙醇晶体中不存在的作用力是( )
| A. | 氢键 | B. | 极性键 | C. | 非极性键 | D. | 离子键 |