题目内容
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是
A.16.7% B.20.0%
C.80.0% D.83.3%
A
解析:
解法1 设N2、H2起始的物质的量分别为x、y、z,N2转化的物质的量为z,得出
N2+3H2![]() 2NH3
2NH3
起始 x y 0
反应 z 3z 2z
平衡x—z y—3z 2z
平衡时总的物质的量为(x-z)+(y-3z)+2z=x+y-2z
即生成氨气的物质的量就是气体总的减少的物质的量。根据2z/(x+y-2z)=20%可得z=(x+y)/12,所以体积缩小的百分率为2z/(x+y)=1/6≈16.7%
解法2 设平衡时混合气体的体积为V,则氨气为20% V,
N2+3H2![]() 2NH3 体积减少2
2NH3 体积减少2
20%V 20%V
则反应前N2和H2体积为V+20%V=120%V=1.2V,减少体积/反应前的体积=(0.2V/1.2V)×100%≈16.7%

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案合成氨联产二甲醚是一项具有中国特色的化工工艺,具有节能环保,其工艺流程如下:
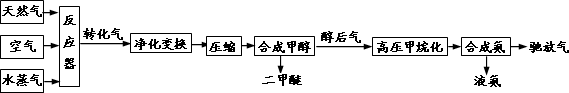
已知造气时,主要发生的反应有:CH4+H2O→CO+3H2………①;2CH4+O2→2CO+4H2………②.
CO、CO2均可与H2合成甲醇,合成甲醇后排出的醇后气中有很少量的CO、CO2,需与H2转化为甲烷,防止CO使合成氨催化剂中毒.
(1)已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1323 kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1;及CO的燃烧热:283 kJ·mol-1.
在一定条件下,CO、H2能生成二甲醚和气态水,该热化学方程式为________.(本题涉及的条件均在同一条件下)
(2)相同体积的天然气,采用“合成氨同时联产二甲醚”和直接合成氨相比,新工艺优越性有________.
a.减少二氧化硫排放
b.适应低碳经济
c.可提高氮肥产量
d.资源综合利用率和经济效益高
(3)下图为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为________.
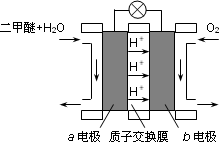
(4)假定造气时产生的转化气中不含CO2,H2与CO物质的量之比为2.2,空气由80% N2和20% O2组成,天然气中CH4为100%,且①和②的转化率均为100%.则同温同压下通入的空气和水蒸气的体积比,V(空气)/V(水蒸气)=________.
(5)今有224 m3(已折合成标准状况)由CO、H2、N2组成的混合气体,分别合成甲醇和氨,且三种气体均完全转化,驰放气中甲烷忽略不计,若得到液氨34 kg,则同时得到二甲醚________千克?




 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)
 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图 所示,根据图回答下列问题:
所示,根据图回答下列问题: