题目内容
14.对于数千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.下图为一“链状连环”图案,图案上由左到右分别写了Cl2、NO2、Na2O2、Na2CO3、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号.
请回答下列问题:
(1)请将分类依据代号填入相应的括号内.
①两种物质都不属于电解质A ②两种物质都属于钠的化合物C
③两种物质都属于氧化物B ④两种物质都属于盐类D
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol•L-1的上图中一种化合物的饱和溶液,可制得一种红褐色的胶体.
①该反应的离子方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+.
②如何用较简单的方法判断胶体是否制备成功?若该分散系能产生丁达尔效应,则制备成功,反之不成功.
③向该胶体中逐滴加入HI稀溶液,会出现一系列变化:
a.先出现红褐色沉淀,原因是电解质溶液氢碘酸能使Fe(OH)3胶体发生聚沉,产生Fe(OH)3沉淀.
b.随后红褐色沉淀溶解,此反应的离子方程式为2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O.
分析 (1)①电解质是在水溶液中或熔融状态下能导电的化合物;
②含有钠元素的化合物称为钠的化合物;
③氧化物由两种元素组成,其中一种是氧元素的化合物;
④盐是阳离子是金属离子或铵根离子,阴离子是酸根离子的化合物;
(2)①制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
②胶体有丁达尔效应:用一束光线照射,能产生一条光亮的通路;
③胶体遇电解质发生聚沉,生成的Fe(OH)3沉淀能与碘化氢发生中和反应.
解答 解:(1)①电解质是在水溶液中或熔融状态下能导电的化合物,电解质包括酸、碱、盐、金属氧化物和水,故H2、CO2不是电解质,
故答案为:A;
②含有钠元素的化合物称为钠的化合物,故Na2O、NaCl为钠的化合物,
故答案为:C;
③两种元素组成,其中一种是氧元素的化合物,CO2、Na2O为氧化物,
故答案为:B;
④盐是阳离子是金属离子或铵根离子,阴离子是酸根离子的化合物,故NaCl、FeCl3为盐,
故答案为:D;
(2)①制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
②溶液不产生丁达尔效应,而氢氧化铁胶体能产生丁达尔效应,
故答案为:若该分散系能产生丁达尔效应,则制备成功;否则,不成功;
③a、加入电解质后,Fe(OH)3胶体发生聚沉,电解质溶液氢碘酸使Fe(OH)3胶体发生聚沉,产生Fe(OH)3沉淀;
故答案为:电解质溶液氢碘酸使Fe(OH)3胶体发生聚沉,产生Fe(OH)3沉淀;
b、随后沉淀溶解,溶液呈黄色,这是氢氧化铁被HI溶解所致,发生氧化还原反应,此反应的离子方程式为:2Fe(OH)3+2I-+6H+=2Fe2++I2+3H2O,
故答案为:2Fe(OH)3+2I-+6H+=2Fe2++I2+3H2O.
点评 本题考查胶体的性质和离子方程式的书写,题目难度中等,注意HI既有酸性又有强还原性,I-能使Fe(OH)3胶粒聚沉,H+使其溶解.

 优学名师名题系列答案
优学名师名题系列答案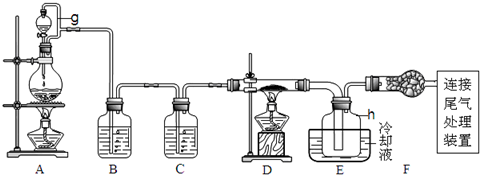
查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | - | 315 | - |
| 熔点/℃ | -70.0 | - | - | - |
| 升华温度/℃ | - | 180 | 300 | 162 |
(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;装置C中的试剂是浓硫酸;装置E中的h瓶需要冷却理由是产物SiCl4沸点低,需要冷凝收集.
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质.为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+.
①写出用KMnO4滴定Fe2+的离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②滴定前是否要滴加指示剂?否(填“是”或“否”),判断滴定终点的方法是当滴入最后一滴KMnO4溶液时,溶液颜色由无色变为紫色,且30秒不褪色.
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响偏低(填“偏高”、“偏低”、或“无影响”)

①将干电池剖切、分选得到黑色混合物(主要成份为MnO2)洗涤、过滤、烘干.
②将上述固体按固液体积比1:4.5加入浓盐酸,反应完全后过滤,浓缩.
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(1)写出第②步反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)请说出第②步反应中产生气体的一种用途杀菌、消毒、制造漂白粉、有机化工合成等.如图1在进行过滤时,操作有何错误:没有使用玻璃棒引流.
(3)查阅文献,发现上反应第③步中除了生成MnCO3之外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长易被氧化成褐色的MnO(OH)2,MnCO3和MnO(OH)2受热最终均分解氧化成MnO2,该课题组对上述沉淀的成份提出以下假设,请帮助他完成假设:
假设一:全部为MnCO3
假设二:全部为Mn(OH)2
假设三:既有MnCO3也有Mn(OH)2 …
(4)①为验证假设二是否正确,该课题组进行了以下研究:
定性研究:请完成下表中的内容
| 实验步骤(不要求写出具体操作过程) | 与其的实验现象和结论 |
| 将所得沉淀过滤、洗涤… | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,假如足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |

 淀粉通过下列转化可以得到多种有机物
淀粉通过下列转化可以得到多种有机物
 .
.
 .
.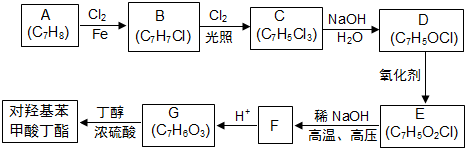
 ; F的分子式为C7H4O3Na2;
; F的分子式为C7H4O3Na2; ,该反应类型为取代反应;
,该反应类型为取代反应;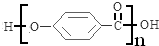 .
.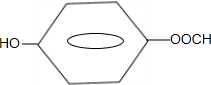 .
.