题目内容
6.以工业碳酸钙(含有少量Na+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2•2H2O的质量分数为97.0%~103.0%)的主要流程如下: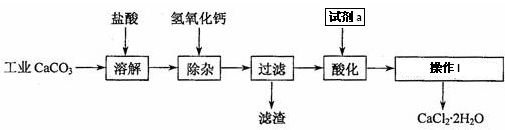
(1)溶解操作过程中发生反应的离子方程式是CaCO3+2H+═Ca2++CO2↑+H2O
除杂操作是加入Ca(OH)2溶液,此过程中发生反应的离子方程式是Fe3++3OH-=Fe(OH)3↓.
(2)酸化操作中加入的试剂a是稀盐酸,其目的是除去Ca(OH)2杂质
(3)酸化之后进行的操作I是蒸发浓缩,冷却结晶,过滤,洗涤,干燥.
(4)测定样品中Cl-含量的方法是:
a.称取 0.7500g样品,溶解,在250mL容量瓶中定容;
b.从容量瓶中量取25.00mL待测溶液于锥形瓶中;用AgNO3溶液与之反应,消耗AgNO3的物质的量为1.00x10-3mol时,25.00mL待测溶液中的Cl-恰好沉淀完全.
①计算上述样品中CaCl2•2H2O的质量分数为98.0%.
②若用上述方法测定的样品中CaCl2•2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有样品中存在少量的NaCl;少量的CaCl2.2H2O失水.
分析 工业碳酸钙加入盐酸可完全溶解生成氯化钙、氯化铁以及氯化钠等,加入氢氧化钙溶液,以除去溶液中少量的Fe3+,然后在酸性条件下蒸发结晶可得到CaCl2•2H2O,
(1)碳酸钙可以和盐酸发生反应生成氯化钙、水以及二氧化碳;加入氢氧化钙生成氢氧化铁沉淀;
(2)加入过量盐酸,可中和氢氧化钙以及防止Ca2+在蒸发时发生水解;
(3)氯化钙溶液获得氯化钙晶体的方法:蒸发浓缩,冷却结晶,过滤,洗涤,干燥;
(4)①根据氯元素守恒,得到氯化钙和硝酸银之间的关系式:2Ag+~2Cl-~CaCl2•2H2O,代入数据计算即可;
②样品中存在少量的NaCl,根据 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大;
解答 解:工业碳酸钙加入盐酸可完全溶解生成氯化钙、氯化铁以及氯化钠等,加入氢氧化钙溶液,以除去溶液中少量的Fe3+,然后在酸性条件下蒸发结晶可得到CaCl2•2H2O,
(1)碳酸钙可以和盐酸发生反应生成氯化钙、水以及二氧化碳,反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,
加入氢氧化钙溶液Fe3+沉淀完全,形成氢氧化铁沉淀,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓;
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;Fe3++3OH-=Fe(OH)3↓;
(2)因除去铁离子需加入过量的氢氧化钙,加入稀盐酸,可中和氢氧化钙以及防止Ca2+在蒸发时发生水解且不引入新的杂质,
故答案为:稀盐酸;除去Ca(OH)2杂质;
(3)氯化钙溶液获得氯化钙晶体的方法:蒸发浓缩,冷却结晶,过滤,洗涤,干燥,
故答案为:蒸发浓缩,冷却结晶,过滤,洗涤,干燥;
(4)①设样品中含CaCl2•2H2O为x mol.
由关系式:2Ag+~2Cl-~CaCl2•2H2O
2 1
10-3mol $\frac{25}{250}$×x mol
解得x=5×10-3mol
w(CaCl2•2H2O)=$\frac{5×10{\;}^{-3}mol×147g/mol}{0.7500g}$=98.0%,
故答案为:98.0%;
②样品中存在少量的NaCl会导致CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大,
故答案为:样品中存在少量的NaCl;少量的CaCl2.2H2O失水.
点评 本题考查了制备实验方案的设计,为高频考点,侧重于学生的分析、实验和计算能力的考查,计算时注意关系式的利用,注意的是从250mL中取25mL,所以在计算时要注意这一点,难度中等.


| A. | 碳棒上有气体放出,溶液酸性变弱 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,电流从a极到b极 | |
| D. | a极上发生了还原反应 |
 对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
实验步骤如下:
①在一个250mL三口烧瓶中加入10mL苯胺及少量固体B,把烧瓶放入冷水中,缓慢地加入18mL浓硫酸.
②把三口烧瓶置于油浴中缓慢加热,控制温度为180℃~190℃,反应1~1.5h.
③将反应液冷却至约50℃,倒入盛有100mL冷水的烧杯中,析出灰白色固体,进行操作C并用少量冷水洗涤固体,得到对氨基苯磺酸粗产品.
④对粗产品进行操作D,再低温烘干即得到纯净的对氨基苯甲酸.
以下为两种有机物的部分物理性质,请回答有关问题.
| 苯胺 | 对氨基苯磺酸 | |
| 熔点 | -6.3℃ | 288℃ |
| 沸点 | 184℃ | (300℃开始分解炭化) |
| 水溶性 | 微溶于水 | 微溶于冷水、溶于热水 |
 .
.(2)装置A的名称为冷凝管,作用是使苯胺冷凝回流.
(3)固体 B的作用是防暴沸,操作C的名称是过滤.
(4)下列说法正确的是AD
A.用液体加热的好处是反应物受热均匀,便于控制温度
B.本实验步骤②也可以改用水浴加热
C.步骤③将反应液倒入100mL冷水的目的是分离苯胺和对氨基苯磺酸
D.步骤③用少量冷水洗涤的目的是除去固体表面的可溶性杂质同时减少洗涤过程中的损失.
(5)操作D的名称是重结晶,具体过程包括:用适量热水溶解粗产品→冷却结晶→过滤、洗涤.
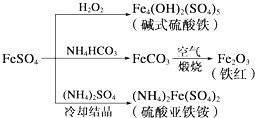
| A. | 制备碱式硫酸铁利用了过氧化氢的氧化性 | |
| B. | 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 | |
| C. | 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 | |
| D. | 制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质 |

查询资料,得有关物质的数据如下表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(2)操作Ⅳ的顺序依次为蒸发浓缩、冷却结晶、过滤、洗涤.
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00mol•L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.54%.
| A. | 10% | B. | 20% | C. | 30% | D. | 40% |
 中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 分子中含有3种官能团 | |
| B. | 易溶于苯,难溶于水 | |
| C. | 可与NaOH溶液发生水解反应 | |
| D. | 其同分异构体不可能有芳香族化合物 |

 某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题:
某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题: .
.