题目内容
6.CH4还原NO可消除氮氧化物的污染,反应方程式为CH4+4NO=2N2+CO2+2H2O.在该反应中,被还原的物质是NO(填化学式),作为还原剂的物质是CH4(填化学式);若反应中消耗了4mol NO,则生成1mol CO2,反应中转移电子的物质的量是8mol.分析 反应CH4+4NO=2N2+CO2+2H2O中,C元素化合价由-4价升高到+4价,被氧化,N元素化合价由+2价降低到0价,被还原,结合电子转移的数目解答该题.
解答 解:反应CH4+4NO=2N2+CO2+2H2O中,C元素化合价由-4价升高到+4价,被氧化,CH4为还原剂,N元素化合价由+2价降低到0价,被还原,NO为氧化剂,
若反应中消耗了4mol NO,由方程式可知生成1molCO2,转移电子的物质的量为4mol×(2-0)=8mol,
故答案为:NO;CH4;1;8mol.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握元素化合价的变化,为解答该题的关键,难度不大.

练习册系列答案
相关题目
16.A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略).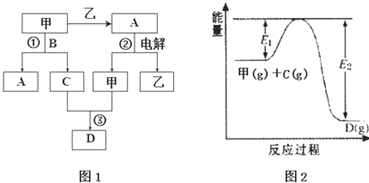
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处 于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
①若方程式系数为最简整数比,则该温度下的平衡常数K=20;填写表中空格:②v正<v逆 ③v正>v逆.

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处 于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 | n(甲) | n(C) | n(D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
17.下列化合物中,属于原子晶体的是( )
| A. | CO2 | B. | NaOH | C. | SiO2 | D. | Si |
14.下列说法中,错误的是( )
| A. | 化学反应必然伴随着能量的变化 | |
| B. | 能量变化是化学反应的基本特征之一 | |
| C. | 化学变化的能量变化主要是由化学键的变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物的状态和物质的量无关 |
1.下列说法错误的是( )
| A. | 明矾常作净水剂 | |
| B. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| C. | 在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 | |
| D. | 汽车尾气中的CO、NO等都是汽油和柴油的不完全燃烧产物 |
11.下列除去杂质(括号内为杂质)的方法中,正确的是( )
| A. | NO(NO2):通过装有水的洗气装置 | |
| B. | Cu粉(铁粉):加足量稀硝酸,过滤 | |
| C. | NH3(H2O):通过装有浓硫酸的洗气装置 | |
| D. | KCl(CaCl2):加适量Na2CO3溶液,过滤 |
18.下列各组物质中,互为同分异构体的是( )
| A. | O2和O3 | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 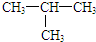 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
15.一位患者镶了两颗假牙,其中一颗是黄金的,另一颗是不锈钢的.自镶上假牙后,他时感头疼,心情烦躁,多次治疗未见好转.如果你是医生,下列方法不能治疗其疾病的是( )
| A. | 将两颗假牙都做成黄金的 | B. | 将两颗假牙都做成不锈钢的 | ||
| C. | 将金假牙改为铝质假牙 | D. | 将两颗假牙都做成特殊树脂的 |
16.碘硫化学循环原理如图1所示.
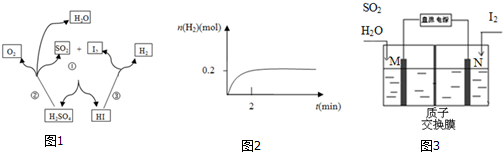
(1)写出反应③的化学方程式2HI$\stackrel{△}{?}$H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
计算CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为43:7.
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.

(1)写出反应③的化学方程式2HI$\stackrel{△}{?}$H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1200-1350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.