题目内容
红钒钠(重铬酸钠:Na2Cr2O7·2H2O,橙红色晶体)是重要的化工原料.工业铬铁矿(FeO·Cr2O3,含少量Al2O3和SiO2)按以下过程来制取红钒钠.
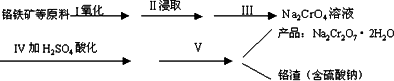
(1)步骤Ⅰ的反应有:4FeO·Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1 mol Na2CrO4转移的电子数为________mol;原料中加入CaCO3的作用是________
A.分解产生CaO,与某些杂质反应形成炉渣
B.分解时放出大量热量,提高煅烧温度
C.分解产生CO2从下而上穿过,使得炉料翻滚,加快原料的煅烧氧化
(2)浸取液中含有铝和硅的化合物,步骤Ⅲ过滤前要用稀H2SO4将浸取液的pH调至7~________
(3)步骤Ⅳ反应为:2CrO42-+2H+=Cr2O72-+H2O,平衡常数表达式为:K=________
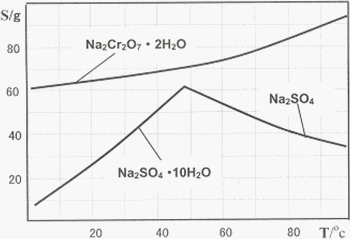
下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线:
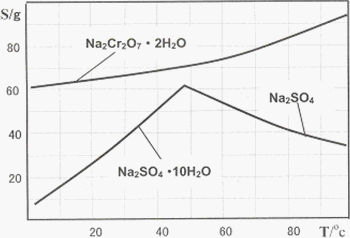
(4)据此,步骤Ⅴ操作的方法是:将IV所得溶液________(填操作),趁热过滤得到的晶体是________(填化学式);然后将所得溶液________(填操作),得到的晶体是________.
解析:
(1)3.5;AC (每空2分,共4分)
(2)AlO2-+H++H2O=Al(OH)3↓(或Al(OH)4-+H+=Al(OH)3↓+H2O)
SiO32-+2H++=H2SiO3↓(或SiO32-+2H++H2O=H4SiO4↓)(每式2分,共4分)
(3)![]() [分子上乘以c(H2O)不扣分] (2分)
[分子上乘以c(H2O)不扣分] (2分)
(4)蒸发浓缩(1分),Na2SO4(1分)(答Na2SO4·10H2O也给分),冷却结晶、过滤(2分),Na2Cr2O7·2H2O (1分)(共5分)

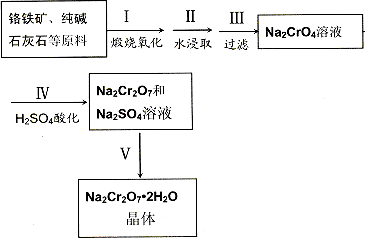
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。

①步骤Ⅰ中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2
8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________。
A.升高温度 B.将原料粉碎
C.增加纯碱的用量 D.通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是________________________。
③步骤Ⅲ需将溶液的pH调至7—8并煮沸,其目的是_______________________________。
④步骤Ⅳ中发生反应的离子方程式为__________________。
(2)将红矾钠与KCl固体按1∶2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程。
序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解 |
② |
|
|
③ |
|
|
④ |
|
|
⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |