题目内容
13.下列关于反应速率的说法正确的是( )| A. | 同一反应中,各个物质的反应速率相同 | |
| B. | 反应速率只与物质的量有关 | |
| C. | 同一反应中,各个物质的反应速率可能相同 | |
| D. | 反应速率的符号是Vm |
分析 A.同一反应中,同一时间段内各物质的反应速率之比等于其计量数之比;
B.反应速率=$\frac{△c}{△t}$;
C.同一反应中,同一时间段内各物质的反应速率之比等于其计量数之比;
D.Vm表示气体摩尔体积,反应速率的符号是v.
解答 解:A.同一反应中,同一时间段内各物质的反应速率之比等于其计量数之比,同一反应同一时间段内计量数相等的物质反应速率相等,故A错误;
B.反应速率=$\frac{△c}{△t}$,根据公式知反应速率与单位时间内物质浓度变化量有关,故B错误;
C.根据A知,同一反应中,如果物质的计量数相等,则各个物质的反应速率可能相同,故C正确;
D.反应速率的符号是v,故D错误;
故选C.
点评 本题考查有关反应速率的知识,较基础,注意反应速率公式含义及速率与计量数的关系,易错选项是B.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
3.下列说法中正确的是( )
| A. | H2和D2互为同位素 | B. | 正丁烷和异丁烷互为同系物 | ||
| C. |  与 与 互为同分异构体 互为同分异构体 | D. |  和 和  是同一种物质 是同一种物质 |
4.卤代烃能发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr.下列有机物中,可合成环烷烃的是( )
| A. | CH3CH2CH2Br | B. | CH3CH2CHBr2 | C. | CH2BrCH2CH2Br | D. | CH3CHBrCH2CH2Br |
1.下列化合物中,含有非极性共价键的离子化合物是( )
| A. | NH4NO3 | B. | CaF2 | C. | Na2S2 | D. | Na3N |
8.图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
请回答下列问题:
(1)写出E元素的离子结构示意图 ;
;
(2)X的值应为C(填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:同周期元素的原子半径越小,电负性越大;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:HCl>H2S>PH3(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:Al(OH)3+3HClO4═Al(ClO4)3+3H2O
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
| 元素编号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出E元素的离子结构示意图
 ;
;(2)X的值应为C(填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:同周期元素的原子半径越小,电负性越大;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:HCl>H2S>PH3(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:Al(OH)3+3HClO4═Al(ClO4)3+3H2O
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
5.用氯气制取并获得碘单质,不能实现实验目的装置是( )
| A. | 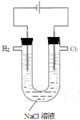 用甲制取少量氯气 | B. | 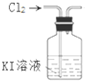 用乙氧化溶液中的碘离子 | ||
| C. | 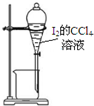 用丙提取置换出来的碘 | D. | 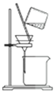 用丁过滤I2的CCl4溶液得碘单质 |
 学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:
学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现: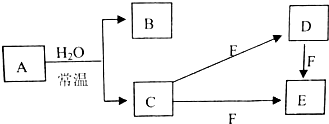
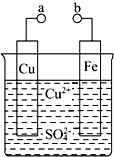 某小组为研究电化学原理,设计如图装置.请回答下列问题:
某小组为研究电化学原理,设计如图装置.请回答下列问题: