题目内容
 (1)等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD.当反应进行一段时间后,测得A减少了n mol,B减少了
(1)等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD.当反应进行一段时间后,测得A减少了n mol,B减少了| n |
| 2 |
| 3 |
| 2 |
①该化学方程式的各系数为a=
②若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态A
(2)化学反应原理在科研和生产中有广泛应用
①利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g)?TaI4(g)+S2(g)△H>0 ( I)
反应( I)的平衡常数表达式K=
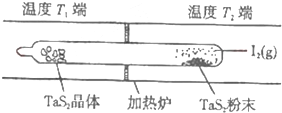
②如图所示,反应( I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)①根据同一化学反应的同一时间段内,参加反应的各物质的物质的量与计量数的关系判断;
②根据压强对化学平衡的影响判断;
(2)①通过题意求出平衡浓度,带入K值可以得出转化率为66.7%;
②通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2.
②根据压强对化学平衡的影响判断;
(2)①通过题意求出平衡浓度,带入K值可以得出转化率为66.7%;
②通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2.
解答:
解:(1)①同一化学反应的同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,所以a:b:c:d=n mol:
mol:
mol:n mol=2:1:3:2,a=2,c=3;
故答案为:2;3;
②压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,根据题意知,该反应前后气体体积不变;
2A+B?3 C+2D,已知生成物C是固体,要使反应前后气体体积不变即计量数不变,那么只能是A、D是气体,B是液体或固体,
故答案为:气体;固体或液体;
(2)①根据题意反应(Ⅰ)的平衡常数表达式K=
;
若K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,
根据K=
=
=1,
解之得:x=66.7%,
故答案为:
;66.7%;
②由所给方程式可知该反应为吸热反应,通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2,I2是可以循环使用的物质;
故答案为:<;I2.
| n |
| 2 |
| 3n |
| 2 |
故答案为:2;3;
②压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,根据题意知,该反应前后气体体积不变;
2A+B?3 C+2D,已知生成物C是固体,要使反应前后气体体积不变即计量数不变,那么只能是A、D是气体,B是液体或固体,
故答案为:气体;固体或液体;
(2)①根据题意反应(Ⅰ)的平衡常数表达式K=
| c(TaI4)c(S2) |
| c2(I2) |
若K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,
根据K=
| c(TaI4)c(S2) |
| c2(I2) |
| 0.5x×0.5x |
| (1-x)2 |
解之得:x=66.7%,
故答案为:
| c(TaI4)c(S2) |
| c2(I2) |
②由所给方程式可知该反应为吸热反应,通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2,I2是可以循环使用的物质;
故答案为:<;I2.
点评:本题考查化学平衡影响因素分析,化学平衡原理的理解应用,化学平衡常数的表达式及其计算,平衡转化率等知识,难度较大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
在同温同压下,下列各组热化学方程式Q2>Q1的是( )
| A、2H2(g)+O2(g)=2H2O(l)△H=-Q1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 | ||||
| B、S(s)+O2(g)=SO2(g)△H=-Q1 S(g)+O2(g)=SO2(g)△H=-Q2 | ||||
C、C(s)+O2(g)=CO2(g)△H=-Q1 C(s)+
| ||||
D、H2(g)+Cl2(g)=2HCl(g)△H=-Q1
|
X、Y、Z、W四种金属,X、Y组成的原电池两极插入稀H2SO4,Y上有气泡产生;把Y放在Z的硝酸盐溶液中,Y表面有Z析出;W放在冷水中剧烈反应,产生气体.其活动顺序为( )
| A、W>X>Y>Z |
| B、W>Z>Y>X |
| C、X>Y>Z>W |
| D、Y>X>Z>W |
将铜投入稀硫酸中不能溶解,但向这种稀硫酸中加入下列某种物质后,发现铜能逐渐溶解,溶液逐渐变成蓝色,并可见有气体产生.则向这种稀硫酸中加入的物质是( )
| A、盐酸 | B、硝酸钾 |
| C、氯化钡 | D、氯化铁 |
氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它.CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关它的推断中错误的是( )
| A、“另一种反应物”一定具有氧化性 |
| B、CuH既可做氧化剂也可做还原剂 |
| C、CuH+Cl2═CuCl+HCl↑(燃烧) |
| D、CuH+HCl═CuCl+H2↑(常温) |
下列有关化学反应速率的说法中正确的是( )
| A、氢气与氮气能够缓慢地反应生成氨气,使用合适的催化剂可以提高化学反应速率 |
| B、等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等 |
| C、用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率 |
| D、增大反应CO2(g)+H2(g)═CO(g)+H2O(g)的压强,反应速率不变 |
对于某些离子的检验及结论正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42? |
| C、加入盐酸无现象,再加氯化钡溶液有白色沉淀生成,原溶液一定有硫酸根离子 |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
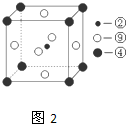 (图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为