题目内容
1.下列离子方程式书写正确的是( )| A. | 氢氧化钠溶液中加入醋酸 H++OH-═H2O | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向碳酸钠溶液中加入盐酸 CO32-+2H+═H2O+CO2↑ | |
| D. | 氧化铜溶于盐酸 O2-+2H+═H2O |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开;
B.铁与稀硫酸反应生成硫酸亚铁;
C.碳酸钠与盐酸反应生成氯化钠、二氧化碳气体和水;
D.氧化铜不能拆开,应该保留化学式.
解答 解:A.醋酸为弱电解质,离子方程式中需要保留分子式,正确的离子方程式为:CH3COOH+OH-=H2O+CH3COO-,故A错误;
B.向稀硫酸溶液中投入铁粉,反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故B错误;
C.向碳酸钠溶液中加入盐酸,反应的离子方程式为:CO32-+2H+═H2O+CO2↑,故C正确;
D.氧化铜溶于盐酸,氧化铜需要保留化学式,正确的离子方程式为:CuO+2H+═Cu2++H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
11.实验室用如图所示装置制备AlCl3溶液,并用AlCl3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备新型的超导材料和发光材料七铝十二钙 (12CaO•7Al2O3).已知AlCl3易水解,易升华.
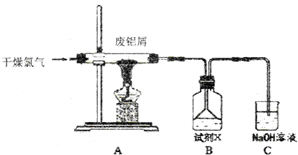
(1)①实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为ClO3-+5Cl-+6H+=3Cl2+3H2O;
②C装置的作用吸收氯气,防止污染空气;
(2)氯气与废铝屑反应生成的AlCl3蒸气溶解在B中,B中盛放的试剂X是盐酸;为了防止AlCl3蒸气凝华堵塞导管,实验中可采取的措施是加粗导管、缩短导管长度、加热导管、通入氮气等(写出一点).
(3)B装置中的AlCl3溶液溶解CaCO3时,AlCl3溶液和碳酸钙粉末的混合方式为碳酸钙粉末慢慢加入到AlCl3溶液中;
(4)实验要控制碳酸钙和AlCl3的量,要求n(CaCO3):n(AlCl3)>12:14,其原因是氢氧化钙微溶于水,造成损失;
(5)以工业碳酸钙(含有少量Al2O3、Fe2O3杂质)生产二水合氯化钙(CaCl2•2H2O)的方法为:将工业碳酸钙溶于盐酸,向溶液中加入氢氧化钙,搅拌,用pH计调节溶液的pH≤4.7,过滤,向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤,冰水洗涤,干燥.
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
(实验中需用到的试剂和仪器有:盐酸,氢氧化钙,冰水,pH计).

(1)①实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为ClO3-+5Cl-+6H+=3Cl2+3H2O;
②C装置的作用吸收氯气,防止污染空气;
(2)氯气与废铝屑反应生成的AlCl3蒸气溶解在B中,B中盛放的试剂X是盐酸;为了防止AlCl3蒸气凝华堵塞导管,实验中可采取的措施是加粗导管、缩短导管长度、加热导管、通入氮气等(写出一点).
(3)B装置中的AlCl3溶液溶解CaCO3时,AlCl3溶液和碳酸钙粉末的混合方式为碳酸钙粉末慢慢加入到AlCl3溶液中;
(4)实验要控制碳酸钙和AlCl3的量,要求n(CaCO3):n(AlCl3)>12:14,其原因是氢氧化钙微溶于水,造成损失;
(5)以工业碳酸钙(含有少量Al2O3、Fe2O3杂质)生产二水合氯化钙(CaCl2•2H2O)的方法为:将工业碳酸钙溶于盐酸,向溶液中加入氢氧化钙,搅拌,用pH计调节溶液的pH≤4.7,过滤,向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤,冰水洗涤,干燥.
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
12.下列各元素,最高正化合价数最大的是( )
| A. | O | B. | Al | C. | F | D. | S |
16.下列有关叙述正确的是( )
| A. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| B. | 制乙烯时,用排水法或向上排空气法收集气体 | |
| C. | 乙烯可作水果的催熟剂 | |
| D. | 78 g苯含有碳碳双键的数目为3NA |
6.下列反应属于吸热反应的是( )
| A. | C6H12O6(葡萄糖aq)+6O2→6CO2+6H2O | B. | CH3COOH+KOH═CH3COOK+H2O | ||
| C. | A+B?C+D;△H<0 | D. | 强碱与铵盐反应 |
10.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硝酸的反应 | |
| B. | 灼热的木炭与CO2的反应 | |
| C. | 过氧化钠与水的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
