题目内容
A、B、C、D四种短周期元素,它们的原子序数依次增大,A和B在同一周期,A原子的p亚层有一个空轨道,B原子的p亚层有两个未成对电子,O.1 molC单质能从酸中置换出2.24 L氢气(标准状况下),形成的C离子与B离子的电子层结构相同。D离子为阳离子,且D离子的半径在B、C、D离子中为最小。则
(1)A ;B ;C ;D 。(均填元素符号)
(2)写出C原子的电子排布式: 。其在周期表中的位置是第 周期 族。
(3)A单质和B单质充分反应生成的化合物的电子式是 ,结构式是 .
(4)我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1 mol这种单质中含中子的物质的量是20 mol,则这种同位素原子的符号为 。
(5)比较C和D的最高价氧化物对应水化物酸性或碱性的强弱: 。
(6)在四种元素中,有一个元素的最高价氧化物对应水化物既能与盐酸反应,又能与氢氧化钠反应。写出这两个反应的离子方程式: , .
(1)C O Mg Al
(2)Mg 1s22s22p63s2 3 ⅡA
(3)如 O=C=0
(4) 818O
(5)碱性:Mg(OH)2> Al(0H)3
(6)3H++A1(OH)3=Al3++3H2O Al(OH)3+0H一=A102-+2H2O

练习册系列答案
相关题目
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比3:4,D分别与A、B、C可形成10个电子的分子X、Y、Z.则下列叙述正确的是( )
| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |

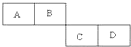 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.