题目内容
下列表示溶液中发生反应的化学方程式或离子方程式错误的是
- A.5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O
- B.2KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
- C.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
- D.3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
B
分析:A.MnO4-中+7价的Mn具有强氧化性,SO32-中+4价的S具有还原性;
B.K2MnO4一定要在强碱性环境中才能稳定存在,在酸性、中性,弱碱性环境中的K2MnO4会发生歧化反应,CO2与KOH反应,生成K2CO3;
C.K2Cr2O7中的Cr为+6价,具有氧化性,FeSO4中的Fe+2价,具有还原性;
D.Fe2+具有还原性,酸性条件下的NO3-具有氧化性.
解答:A.SO32-中+4价的S被氧化成+6价的硫,MnO4-中+7价的Mn被还原成+2价的Mn,5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,故A正确;
B.碱性条件下,产物CO2与KOH 反应,2KOH+CO2=K2CO3+H2O,正确反应为:2KMnO4+HCOOK+3KOH=2K2MnO4+K2CO3+2H2O,故B错误;
C.K2Cr2O7中的Cr为+6价,变为产物中+3价的Cr,1molK2Cr2O7中含2molCr,得6mol电子,FeSO4中的Fe+2价,变为产物中+3价的Fe,失去1mol电子,故FeSO4前的系数为6,K2Cr2O7前的系数为1,K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O,故C正确;
D.Fe2+从+2价,变成+3价,失去1个电子,NO3-中的氮从+5价变为+2价,得3个电子,所以,Fe2+前的系数为3,NO3-前的系数为1,3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故D正确;
故选B.
点评:该题书写方程式时,需考虑反应溶液的酸碱性,不同的介质反应的产物不同,不同的介质反应的产物不同,解题时需考虑产物在介质中能否稳定存在,并能熟练掌握运用得失电子守恒配平氧化还原反应.
分析:A.MnO4-中+7价的Mn具有强氧化性,SO32-中+4价的S具有还原性;
B.K2MnO4一定要在强碱性环境中才能稳定存在,在酸性、中性,弱碱性环境中的K2MnO4会发生歧化反应,CO2与KOH反应,生成K2CO3;
C.K2Cr2O7中的Cr为+6价,具有氧化性,FeSO4中的Fe+2价,具有还原性;
D.Fe2+具有还原性,酸性条件下的NO3-具有氧化性.
解答:A.SO32-中+4价的S被氧化成+6价的硫,MnO4-中+7价的Mn被还原成+2价的Mn,5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,故A正确;
B.碱性条件下,产物CO2与KOH 反应,2KOH+CO2=K2CO3+H2O,正确反应为:2KMnO4+HCOOK+3KOH=2K2MnO4+K2CO3+2H2O,故B错误;
C.K2Cr2O7中的Cr为+6价,变为产物中+3价的Cr,1molK2Cr2O7中含2molCr,得6mol电子,FeSO4中的Fe+2价,变为产物中+3价的Fe,失去1mol电子,故FeSO4前的系数为6,K2Cr2O7前的系数为1,K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O,故C正确;
D.Fe2+从+2价,变成+3价,失去1个电子,NO3-中的氮从+5价变为+2价,得3个电子,所以,Fe2+前的系数为3,NO3-前的系数为1,3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故D正确;
故选B.
点评:该题书写方程式时,需考虑反应溶液的酸碱性,不同的介质反应的产物不同,不同的介质反应的产物不同,解题时需考虑产物在介质中能否稳定存在,并能熟练掌握运用得失电子守恒配平氧化还原反应.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
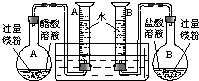 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.