题目内容
【题目】防治雾雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(l) PM2.5是环保部门监测空气质量的重要指标。将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子的种类和平均浓度如下表:
离子种类 | Na+ | NH4+ | SO42- | NO3- |
浓度/(mol/L) | 2.0×l0-6 | 2.8×10-5 | 3.5×10-5 | 6.0×l0-5 |
则试样的pH为____________。
(2)雾霾的主要成分之一是来自汽车尾气的氮氧化物,研究表明CH4可以消除汽车尾气中氮氧化物的污染。
① CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-889.6KJ/mol
② N2(g)+2O2(g)=2NO2(g)ΔH=+67.2KJ/mol
③ 2NO2(g) ![]() N2O4(g) ΔH=-56.9KJ/mol
N2O4(g) ΔH=-56.9KJ/mol
写出甲烷气体催化还原N2O4气体生成稳定的单质气体、二氧化碳气体和液态水的热化学方程式:_____。
(3)一定条件下,以CO 和H2合成清洁能源CH3OH,其热化学方程式为CO(g) + 2H2(g) ![]() CH3OH (g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:
CH3OH (g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:
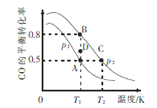
①该可逆反应的ΔH_____0(填“>”“<”“=”)。A,B, C三点对应的平衡常数KA、KB、KC的大小关系是_________。压强:p1_______p2(填“>”“<”“=”)。在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:v正________v逆(填“>”“<”“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是__________(填字母)
A. CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2mol CO和4mol H2,在p2、T2条件下达到平衡状态C点,此时容器容积为2L,则在该条件下反应的平街常数K为______________。
【答案】 4 CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(1) ΔH=-899.9KJ/mol < KA=KB>KC < > AC 1
【解析】(1)根据电荷守恒可知氢离子浓度=(3.5×10-5×2+6.0×l0-5-2.0×l0-6-2.8×10-5)mol/L=10-4mol/L,因此试样的pH为4;(2)已知:① CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-889.6kJ/mol,② N2(g)+2O2(g)=2NO2(g)ΔH=+67.2kJ/mol,③ 2NO2(g) ![]() N2O4(g) ΔH=-56.9kJ/mol,根据盖斯定律①-②-③即得到甲烷气体催化还原N2O4气体生成稳定的单质气体、二氧化碳气体和液态水的热化学方程式:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(1) ΔH=-899.9kJ/mol。(3)①升高温度CO转化率降低,说明升高温度平衡向逆反应方向进行,因此该可逆反应的ΔH<0。平衡常数只与温度有关系,则A,B,C三点对应的平衡常数KA、KB、KC的大小关系是KA=KB>KC。正反应体积减小,增大压强平衡向正反应方向进行,转化率增大,则压强:p1<p2。在T1条件下,由D点到B点过程中,转化率升高,反应向正反应方向进行,所以正、逆反应速率之间的关系:v正>v逆。②A. CO的体积分数保持不变说明正逆反应速率相等,达到平衡状态,A正确;B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内混合气体的密度保持不变不能说明反应达到平衡状态,B错误;C.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器内混合气体的平均摩尔质量保持不变说明反应达到平衡状态,C正确;D.单位时间内消耗CO的浓度始终等于生成CH3OH的浓度,D错误,答案选AC。③
N2O4(g) ΔH=-56.9kJ/mol,根据盖斯定律①-②-③即得到甲烷气体催化还原N2O4气体生成稳定的单质气体、二氧化碳气体和液态水的热化学方程式:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(1) ΔH=-899.9kJ/mol。(3)①升高温度CO转化率降低,说明升高温度平衡向逆反应方向进行,因此该可逆反应的ΔH<0。平衡常数只与温度有关系,则A,B,C三点对应的平衡常数KA、KB、KC的大小关系是KA=KB>KC。正反应体积减小,增大压强平衡向正反应方向进行,转化率增大,则压强:p1<p2。在T1条件下,由D点到B点过程中,转化率升高,反应向正反应方向进行,所以正、逆反应速率之间的关系:v正>v逆。②A. CO的体积分数保持不变说明正逆反应速率相等,达到平衡状态,A正确;B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内混合气体的密度保持不变不能说明反应达到平衡状态,B错误;C.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器内混合气体的平均摩尔质量保持不变说明反应达到平衡状态,C正确;D.单位时间内消耗CO的浓度始终等于生成CH3OH的浓度,D错误,答案选AC。③
CO(g) + 2H2(g)![]() CH3OH (g)
CH3OH (g)
起始量(mol) 2 4 0
转化量(mol) 1 2 1
平衡量(mol) 1 2 1
三种物质的浓度分别是(mol/L)0.5、1、0.5,所以在该条件下反应的平街常数K为![]() 。
。



