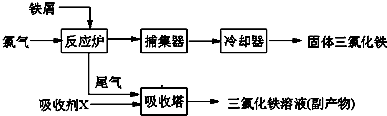
题目内容
FeCl3溶液中,加入难溶于水的CaCO3粉末,观察到CaCO3逐渐溶解,产生无色气体和红褐色沉淀。则:
(1)气体为___,红褐色沉淀为____。
(2)上述现象产生的理由是___。
(1)气体为___,红褐色沉淀为____。
(2)上述现象产生的理由是___。
(1)CO2 ;Fe( OH)3
(2) FeCl3在溶液中水解呈酸性:Fe3+ +3H2O Fe(OH)3+3H+:
Fe(OH)3+3H+:
加入CaCO3逐渐与H+反应:CaCO3+2H+=Ca2++ H2O+CO2↑;消耗H+使Fe3+水解平衡向右移而出现红褐色沉淀
(2) FeCl3在溶液中水解呈酸性:Fe3+ +3H2O
 Fe(OH)3+3H+:
Fe(OH)3+3H+:加入CaCO3逐渐与H+反应:CaCO3+2H+=Ca2++ H2O+CO2↑;消耗H+使Fe3+水解平衡向右移而出现红褐色沉淀

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
下列说法正确的是( )
| A、相同温度下,等体积的任何气体所含的气体分子数相同 | B、原子间形成化学健,既与核外电子有关,又与原子核有关 | C、C、Si为同一主族元素,所形成的最高价氧化物的晶体类型相同 | D、向饱和FeCl3溶液中滴加过量的氨水可制取氢氧化铁胶体 |