题目内容
【题目】(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO32-移向__极(填“正”或“负”),负极的电极反应式为__,正极的电极反应式为___。
(2)某实验小组同学对电化学原理进行了一系列探究活动。
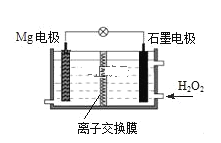
①如图为某实验小组依据的氧化还原反应:__(用离子方程式表示)设计的原电池装置。
②其他条件不变,若将CuCl2溶液换为HCl溶液,石墨的电极反应式为___。

(3)如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。试回答下列问题:

①A极材料是___,电极反应为___,B极材料是__,主要电极反应为__,电解质溶液为___。
②乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈___色。
③常温下,若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为___,若此时乙池剩余液体为400mL,则电解后溶液pH为___。
【答案】负 CH4+4CO32--8e-=5CO2+2H2O 2O2+8e-+4CO2=4CO32- Fe+Cu2+=Fe2++Cu 2H++2e-=H2↑ 纯铜 Cu2++2e-=Cu 粗铜 Cu-2e-=Cu2+ CuSO4溶液 红 4.48L 14
【解析】
(1)原电池放电时,阳离子移向正极、阴离子移向负极;以熔融盐为电解质的甲烷燃料电池放电时,甲烷在负极失电子生成二氧化碳和水;氧气在正极得电子生成碳酸根离子。
(2)①根据电池总反应回答;
②铁与盐酸反应放出氢气;
(3)①电解法精炼铜,粗铜作阳极、精铜作阴极,硫酸铜作电解质溶液;
②乙池中Fe作阴极,阴极氢离子得电子生成氢气;
③常温下,甲池中阴极增重12.8g,即生成铜的质量是12.8g,根据电子守恒计算。
(1)原电池放电时,阴离子移向负极,所以CO32-移向负极;以熔融盐为电解质的甲烷燃料电池放电时,甲烷在负极失电子生成二氧化碳和水,负极反应式是CH4+4CO32--8e-=5CO2+2H2O;氧气在正极得电子生成碳酸根离子,正极反应式是2O2+8e-+4CO2=4CO32-。
(2)①根据图示,铁是负极,电池总反应是Fe+Cu2+=Fe2++Cu,所以依据氧化还原反应Fe+Cu2+=Fe2++Cu设计的原电池装置;
②铁与盐酸反应放出氢气,所以正极放出氢气,石墨的电极反应式为2H++2e-=H2↑;
(3)①电解法精炼铜,A极是阴极,电极材料是纯铜,电极反应为Cu2++2e-=Cu,B是阳极,阳极材料是粗铜,主要电极反应为Cu-2e-=Cu2+,电解质溶液为CuSO4溶液。
②乙池中Fe作阴极,阴极氢离子得电子生成氢气,电极反应式是2H2O+2e-= H2↑+2OH-,溶液显碱性,Fe极附近溶液呈红色;
③常温下,甲池中阴极增重12.8g,即生成铜的质量是12.8g,电路中转移电子的物质的量是![]() 0.4mol,乙池中阳极放出的气体是氯气,根据电子守恒,生成氯气的物质的量是0.2mol,在标准状况下的体积是0.2mol×22.4L/mol=4.48L;根据2H2O+2e-= H2↑+2OH-,生成氢氧根离子的物质的量是0.4mol,氢氧根离子的浓度是
0.4mol,乙池中阳极放出的气体是氯气,根据电子守恒,生成氯气的物质的量是0.2mol,在标准状况下的体积是0.2mol×22.4L/mol=4.48L;根据2H2O+2e-= H2↑+2OH-,生成氢氧根离子的物质的量是0.4mol,氢氧根离子的浓度是![]() 1mol/L,所以pH=14。
1mol/L,所以pH=14。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】Ⅰ、下图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前后盛放盐酸的滴定管中液面的位置。

实验编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的读数(mL) | 滴定后盐酸的读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 1.21 | 29.21 |
3 | 20.00 | 1.50 | 23.48 |
请回答下列问题:
(1)仪器A的名称是_________________。
(2)盐酸的体积读数:滴定前读数为___________,滴定后读数为_____________。
(3)某实验小组同学的三次实验的实验数据如上表所示。根据表中数据计算出待测NaOH溶液的平均溶度是____________mol/L(保留四位有效数字)。
(4)对下列几种假定情况进行讨论:
①取待测溶液的滴定管,放液前滴定管尖端有气泡,放液后气泡消失,对测定结果的影响是____________(填“无影响”“偏高”或“偏低”,下同)
②滴定前锥形瓶未用待测液润洗,对测定结果的影响是_______________;
Ⅱ、氧化还原滴定实验与酸碱中和滴定类似,原理是用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。现用0.001mol/L酸性KMnO4溶液滴定位置浓度的Na2SO3溶液,反应的离子方程式是2MnO4- + 5SO32- + 6H+=2Mn2+ + 5SO42- + 3H2O。请回答下列问题:
(1)该滴定实验所需仪器有________________。
A、酸式滴定管(50mL) B、碱式滴定管(50mL) C、量筒(10mL) D、锥形瓶 E、铁架台F、滴定管夹 G、烧杯 H、胶头滴管 I、漏斗
(2)实验时,应用_____________(填“酸式”或“碱式”,下同)滴定管盛放高锰酸钾溶液,应用__________滴定管盛放亚硫酸钠溶液。
(3)该实验_____________(填“需要”或“不需要”)加入指示剂,原因是_____________。滴定达到终点的标志是__________________。