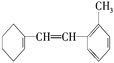
题目内容
【题目】[化学——选修3:物质结构与性质】
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29。回答下列问题:
(1)五种元素中第一电离能最大的是 (填元素符号),其中D原子价电子排布图为 。
(2)元素B的简单气态氢化物的沸点 (填“高于”或“低于”)元素A的简单气态氢化物的沸点,其主要原因是 ; A的简单气态氢化物中心原子的杂化轨道类型为 。
(3)BC3-的立体构型为 ,与其互为等电子体的分子是 (写化学式)。
(4)EC在加热条件下容易转化为E2C,从原子结构的角度解释原因 ;E原子的外围电子排布式为 ,E晶体的堆积方式为 (填序号)
①简单立方堆积 ②体心立方堆积
③六方最密堆积 ④面心立方最密堆积
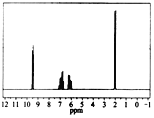
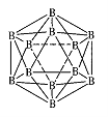
(5)硼与D可形成一种耐磨材料F,其结构与金刚石相似(如右图),可由硼的三溴化物和D的三溴化物于高温下在氢气的氛围中合成。写出合成F的化学方程式: 。F的晶胞边长为a pm,则该晶体密度的表达式为 g·cm-3。 (用含a、NA的式子表示,不必化简)。
【答案】(1)N ![]()
(2)高于 NH3分子间形成氢键,而CH4分子间没有氢键 sp3
(3)平面三角形 SO3、SeO3、BF3、BCl3等
(4)Cu2+价电子为3d9, 而Cu+价电子为3d10,处于全充满状态,能量低,稳定。
[Ar]3d104s1或1s22s22p63s23p63d104s1 ④
(5)Br3+PBr3+3H2![]() BP+6HBr
BP+6HBr ![]()
【解析】
试题分析:A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代,则A为碳元素; B与A同周期,其s能级电子数比p能级电子数多,原子核外电子数排布式为1s22s22p3,则B为N元素;C原子的最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D与B同主族,则D为P元素;E的原子序数为29,则E为Cu;(1)非金属性越强第一电离能越大,N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故N元素的第一电离能最大,D为P元素,原子价电子排布式为3s23p3,原子价电子排布图为  ;(2)元素A、B的简单气态氢化物分别为CH4、NH3,NH3分子之间存在氢键,沸点高于甲烷的,甲烷分子中C原子形成4个C-H将,没有孤对电子,故碳原子采取sp3杂化,故答案为:高于;NH3分子之间存在氢键;sp3;
;(2)元素A、B的简单气态氢化物分别为CH4、NH3,NH3分子之间存在氢键,沸点高于甲烷的,甲烷分子中C原子形成4个C-H将,没有孤对电子,故碳原子采取sp3杂化,故答案为:高于;NH3分子之间存在氢键;sp3;
(3)NO3-中N原子孤电子对数=(5+1-2×3)/2=0,价层电子对数=3+0=3,立体构型为平面三角形,与其互为等电子体的分子是SO3;
(4)Cu2+离子外围电子排布为3d9,而Cu+离子外围电子排布为3d10,为全满稳定状态,Cu2O更稳定,CuO在加热条件下容易转化为Cu2O,Cu原子的外围电子排布式为:3d104s1,Cu晶体的堆积方式为面心立方最密堆积,故答案为:Cu2+离子外围电子排布为3d9,而Cu+离子外围电子排布为3d10,为全满稳定状态,Cu2O更稳定;3d104s1;④;
(5)硼与P可形成一种耐磨材料F,其结构与金刚石相似(如图),则F为BP,可由硼的三溴化物和D的三溴化物于高温下在氢气的氛围中合成,合成F的化学方程式:BBr3+PBr3+3H2![]() BP+6HBr,
BP+6HBr,
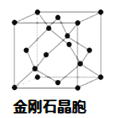
金刚石晶胞中C原子数目为4+8×![]() +6×
+6×![]() =8,则晶胞中B、P原子数目均为4,晶胞质量为4×(11+31)/NAg,晶胞边长为a pm,则该晶体密度为4×(11+31)/NAg÷(a×10-10 cm)3=
=8,则晶胞中B、P原子数目均为4,晶胞质量为4×(11+31)/NAg,晶胞边长为a pm,则该晶体密度为4×(11+31)/NAg÷(a×10-10 cm)3=![]() 。
。

【题目】I.已知:反应
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH = —115.6 kJ/mol
2Cl2(g)+2H2O(g) ΔH = —115.6 kJ/mol
H2(g) + Cl2(g) = 2HCl(g) ΔH = —184 kJ/mol
H2O(g) = H2O(l) ΔH = —44 kJ/mol
写出H2燃烧热的热化学方程式 。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:![]() ,它所对应的化学方程式为:
,它所对应的化学方程式为:
(2)在一定体积的密闭容器中,进行如下化学反应:
A(g) + 3B(g)![]() 2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
T/K | 300 | 400 | 500 | … |
K/(mol·L-1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)已知N2 (g)+ 3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
①在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为: ,用氮气表示的反应速率为: 。
②保持①中的温度和容积不变,设a、b、c分别代表初始加入的N2、H2、NH3的物质的量,若反应达平衡后,混合气体中NH3的体积分数与①中的相同,那么: 若a= 0.5,c= 3,则b= ,在此情况下反应起始时将向 反应方向进行。
③保持①中的温度和容积不变,若按下列四种配比作为起始物质,达平衡后容器内N2的转化率大于①中的是 。(填序号)
A.4molNH3 B.1.5molN2、7.5molH2和1molNH3
C.1molN2、5molH2和2molNH3 D.1molN2、6molH2和2molNH3
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。
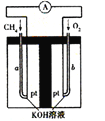
①放电时,负极的电极反应式为 。
②假设装置中盛装100.0 mL 3.0 mol·L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL。放电完毕后,电解质溶液中的溶质是 电解质溶液中各离子浓度的大小关系为 。