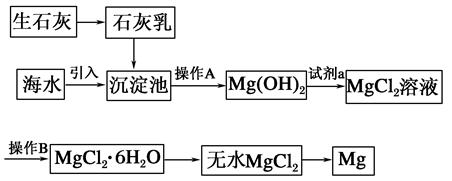
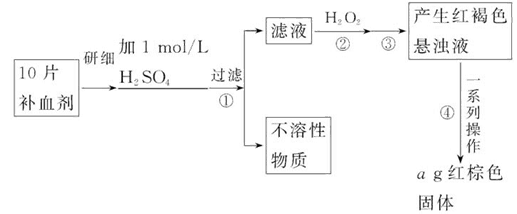
题目内容
有关物质间转化关系如下图,试回答:
(1)转化①的反应条件为 .
(2)转化②的化学方程式为 .转化③的离子方程式为 .
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择 (填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为 或 mL。
(1)电解
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑,MnO2+4H++2Cl- Cl2↑+Mn2++2H2O
Cl2↑+Mn2++2H2O
(3)氨水
(4)150ml、550ml
解析试题解析:(1)由氧化铝制取铝单质,通过电解的方法。
(2)转化②是指铝和氢氧化钠溶液的反应,所以方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,转化③是指二氧化锰与浓盐酸反应制取氯气,所以离子方程式为MnO2+4H++2Cl- Cl2↑+Mn2++2H2O。
Cl2↑+Mn2++2H2O。
(3)因为氢氧化铝易溶解于强碱溶液,所以制备氢氧化铝时常用弱碱溶液氨水。
(4)由题意可知氯化铝的物质的量为0.15mol, Al3+离子有1/3转化为Al(OH) 3时,有两种情况:一、NaOH不足,这时有0.05mol的Al(OH) 3生成则需要NaOH0.15mol,体积为150ml;二、NaOH过量时,生成0.15mol的Al(OH) 3需要0.45mol的NaOH,再溶解0.1mol的Al(OH) 3需要0.1mol的NaOH,所以共需要0.55mol的NaOH,体积为550ml。
考点:考查铝单质的制取、铝的化合物的化学性质、实验室制氯气的方法及简单计算

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案铁单质及其化合物在生活、生产中应用广泛。请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是 。
(2)由于氧化性Fe3+>Cu2+氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是 。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是 (用离子方程式表示)。在使用时发现硫酸铁不能将酸性废水中的悬浮物沉降除去,其原因是 。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4十4CO 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
| | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 一定温度下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |