题目内容
利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.请回答下列问题:
(1)已知COCl2分子的结构式为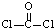 ,则COCl2分子内含有
,则COCl2分子内含有
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
(2)Fe(CO)5中铁的化合价为0,写出Fe元素基态原子的价电子排布式
Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可以判断Fe(CO)5晶体类型为
(3)Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是
(4)与CO分子互为等电子体的分子和离子各写出1种,分别为
(1)已知COCl2分子的结构式为
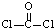 ,则COCl2分子内含有
,则COCl2分子内含有D
D
(填标号);A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
(2)Fe(CO)5中铁的化合价为0,写出Fe元素基态原子的价电子排布式
3d64s2
3d64s2
;Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可以判断Fe(CO)5晶体类型为
分子晶体
分子晶体
.(3)Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是
金属键
金属键
.(4)与CO分子互为等电子体的分子和离子各写出1种,分别为
N2
N2
和CN-
CN-
(填化学式).分析:(1)根据一个单键是一个σ键,一个双键中含有一个σ键和1个π键;
(2)Fe的原子数序为26,结合能量最低原理书写电子排布式;根据分子晶体的熔沸点较低;
(3)根据生成物判断形成的化学键;
(4)根据等电子体中原子数相同,价电子数相同来分析.
(2)Fe的原子数序为26,结合能量最低原理书写电子排布式;根据分子晶体的熔沸点较低;
(3)根据生成物判断形成的化学键;
(4)根据等电子体中原子数相同,价电子数相同来分析.
解答:解:(1)COCl2分子的结构式为: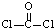 ,分子中含有2个单键和1个双键,则COCl2分子内含有3个σ键、1个π键,
,分子中含有2个单键和1个双键,则COCl2分子内含有3个σ键、1个π键,
故选:D;
(2)Fe的原子数序为26,电子排布式为:1s22s22p63s23p63d64s2,价电子排布式为:3d64s2;Fe(CO)5常温下呈液态,熔沸点较低,为分子晶体;
故答案为:1s22s22p63s23p63d64s2;分子晶体;
(3)Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,断裂的只有配位键,反应生成Fe,则形成金属键,
故答案为:金属键;
(4)等电子体中原子数和价电子数都相同,N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,故答案为:N2;CN-.
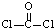 ,分子中含有2个单键和1个双键,则COCl2分子内含有3个σ键、1个π键,
,分子中含有2个单键和1个双键,则COCl2分子内含有3个σ键、1个π键,故选:D;
(2)Fe的原子数序为26,电子排布式为:1s22s22p63s23p63d64s2,价电子排布式为:3d64s2;Fe(CO)5常温下呈液态,熔沸点较低,为分子晶体;
故答案为:1s22s22p63s23p63d64s2;分子晶体;
(3)Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,断裂的只有配位键,反应生成Fe,则形成金属键,
故答案为:金属键;
(4)等电子体中原子数和价电子数都相同,N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,故答案为:N2;CN-.
点评:本题考查较为综合,涉及多个方面的知识,题目难度中等,学习中注重相关基础知识和解题方法的积累.

练习册系列答案
相关题目
(8分)研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是__________________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:______________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4[来源:学科网ZXXK] |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)利用CO可以合成化工原料COCl2。请判断COCl2分子内含有________。
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3个σ键、1个π键
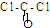 ,则COCl2分子内含有
,则COCl2分子内含有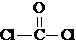 ,②COCl2分子内含有
,②COCl2分子内含有