题目内容
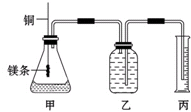 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:Ⅰ.(1)配制浓度均为0.50mol?L-1 H2SO4和H2C2O4溶液;
(2)用
(3)分别称取除去表面氧化膜的镁条并系于铜丝末端;
(4)检查装置的气密性,在广口瓶中装满水,按图连接好装置;
(5)将铜丝向下移动,使足量镁条浸入酸中(铜丝不能与酸接触),至反应完全,记录
(6)反应结束后,读取量筒中水的体积为y mL.
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84g?cm-3 98%的浓硫酸配制250mL 0.50mol?L-1的H2SO4溶液,所需要的主要仪器有
(2)以下是读取量筒内水的体积时必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是
(4)简述速率不等的原因是
分析:Ⅰ(2)根据酸式滴定管和碱式滴定管的使用要求以及精确度来选择;
(5)比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化;
Ⅱ(1)根据配制一定物质的量浓度的溶液步骤选用仪器;
(2)根据先冷却、再调整高度相等、最后读出量筒中体积的顺序排列即可;
(3)读数时要保持左右气体压强相等,以减少误差;
(4)从影响化学反应速率的因素来分析;根据镁与铜易形成原电池,加快反应速率,干扰实验测定.
(5)比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化;
Ⅱ(1)根据配制一定物质的量浓度的溶液步骤选用仪器;
(2)根据先冷却、再调整高度相等、最后读出量筒中体积的顺序排列即可;
(3)读数时要保持左右气体压强相等,以减少误差;
(4)从影响化学反应速率的因素来分析;根据镁与铜易形成原电池,加快反应速率,干扰实验测定.
解答:Ⅰ.(2)题中要求酸的体积10.00 mL较精确,应选酸式滴定管,如用碱式滴定管会腐蚀橡胶管,
故答案为:酸式滴定管;
(5)比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化,
故答案为:反应所需时间;
Ⅱ.(1)用密度为1.84g?cm-3 98%的浓硫酸配制250mL 0.50mol?L-1的H2SO4溶液,需要选用250mL容量瓶,定容时需要使用胶头滴管定容,所以还缺少250mL容量瓶和胶头滴管,
故答案为:250mL容量瓶;胶头滴管;
(2)应该先将溶液冷却到室温,然后使乙、丙中液面相平,最后读出量筒中溶液体积,所以正确顺序为:
故答案为:②①③;
(3)读数时要保持左右气体压强相等,以减少误差,所以应该将量筒缓缓向下移动,使乙、丙中液面相平,
故答案为:将丙向下移动;
(4)影响化学反应速率的因素有浓度、温度、压强等,本题为浓度不同,故答案为:H+浓度不同;镁与铜易形成原电池,加快反应速率,干扰实验测定,所以铜丝不与酸接触,
故答案为:氢离子浓度不同;镁与铜易形成原电池,加快反应速率,干扰实验的测定.
故答案为:酸式滴定管;
(5)比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化,
故答案为:反应所需时间;
Ⅱ.(1)用密度为1.84g?cm-3 98%的浓硫酸配制250mL 0.50mol?L-1的H2SO4溶液,需要选用250mL容量瓶,定容时需要使用胶头滴管定容,所以还缺少250mL容量瓶和胶头滴管,
故答案为:250mL容量瓶;胶头滴管;
(2)应该先将溶液冷却到室温,然后使乙、丙中液面相平,最后读出量筒中溶液体积,所以正确顺序为:
故答案为:②①③;
(3)读数时要保持左右气体压强相等,以减少误差,所以应该将量筒缓缓向下移动,使乙、丙中液面相平,
故答案为:将丙向下移动;
(4)影响化学反应速率的因素有浓度、温度、压强等,本题为浓度不同,故答案为:H+浓度不同;镁与铜易形成原电池,加快反应速率,干扰实验测定,所以铜丝不与酸接触,
故答案为:氢离子浓度不同;镁与铜易形成原电池,加快反应速率,干扰实验的测定.
点评:本题考查了探究影响化学反应速率的因素的方法,涉及了配制一定浓度的溶液的仪器选用、化学基本所以实验操作等知识,题目难度中等,注意掌握影响化学反应速率的因素.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下:
