题目内容
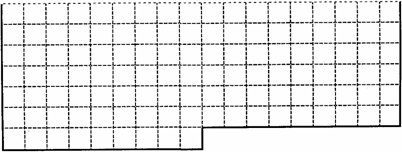
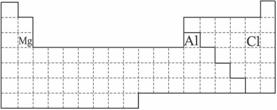
(1)下表中的实线是元素周期表的部分边界,请在表中用实线补全元素周期表的边界.

(2)元素甲是第3周期、第ⅥA族元素,请在下边方框中按氦元素的式样写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外层电子排布.

(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:________>________.甲、乙的最高价氧化物水化物的酸性强弱为________>________(用化学式表示).
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的________,请写出元素在元素周期表中的位置与元素原子结构的关系:________.
答案:
解析:
解析:
|
答案:(1)
(2)
(3)Al SH2 SO4 Al(OH)3 (4)周期性变化元素的周期数即为原子核外电子层数,元素的主族序数即为原子的最外层电子数. 思路解析:(1)略 (2)因甲位于第3周期、第ⅥA族,则应是硫元素,答案为
(3)因乙元素的3p亚层只有一个电子,即其电子排布式为1s22s22p63s23p1,即乙元素是Al,其原子半径大于硫,甲、乙的最高价氧化物对应水化物分别为H2SO4和Al(OH)3,显然酸性前者强于后者. (4)元素周期律的本质是元素原子核外电子排布的周期性变化.因此元素周期表不是随意设定的,并且元素在周期表中的位置与原子结构密切相关,元素的周期数即为原子核外电子层数;元素所在主族序数即为原子的最外层电子数. |

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目




 →
→