题目内容
反应I2(g)+H2(g)?2HI(g)△H=-14.9kJ/mol.温度为T1时,平衡常数K(T1)=43;温度调至T2时,K(T2)=48.74.下列说法不正确的是( )
| A.该反应为放热反应 |
| B.由T1到T2是降温过程 |
| C.T1时,增大c(H2),K(T1)不变 |
| D.T2时,I2(g)的转化率比T1时小 |
A、由热化学方程式可知,反应热△H<0,该反应正反应为放热反应,故A正确;
B、平衡常数K(T1)=43;温度调至T2时,K(T2)=48.74,温度为T1时平衡常数小于T2时平衡常数,说明温度由T1时调至T2时平衡正反应移动,该反应正反应为放热反应,降低温度平衡向正反应反应移动,故温度T1<T2,由T1到T2是降温过程,故B正确;
C、平衡常数只受温度影响,温度不变,平衡常数不变,与反应混合物浓度无关,故T1时,增大c(H2),K(T1)不变,故C正确;
D、由B可知,温度T1<T2,该反应正反应为放热反应,降低温度平衡向正反应反应移动,T2时,I2(g)的转化率增大,故D错误;
故选D.
B、平衡常数K(T1)=43;温度调至T2时,K(T2)=48.74,温度为T1时平衡常数小于T2时平衡常数,说明温度由T1时调至T2时平衡正反应移动,该反应正反应为放热反应,降低温度平衡向正反应反应移动,故温度T1<T2,由T1到T2是降温过程,故B正确;
C、平衡常数只受温度影响,温度不变,平衡常数不变,与反应混合物浓度无关,故T1时,增大c(H2),K(T1)不变,故C正确;
D、由B可知,温度T1<T2,该反应正反应为放热反应,降低温度平衡向正反应反应移动,T2时,I2(g)的转化率增大,故D错误;
故选D.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
从下列实验事实所引出的相应结论正确的是( )
|
关于下列图象的叙述正确的是( )
A、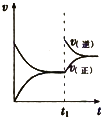 表示:反应I2(g)+H2(g)?2HI(g)△H<0的v-t关系,其中t1时刻改变的条件为升高温度 | B、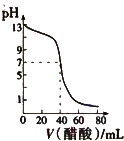 表示:25℃时,用醋酸溶液滴定40.00mL 0.1000mol?L-1 NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol?L-1 | C、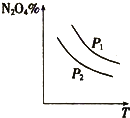 表示:反应2NO2(g)?N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2 | D、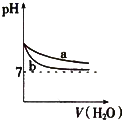 表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水 |