题目内容
关于下列图象的叙述正确的是( )
A、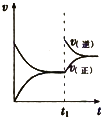 表示:反应I2(g)+H2(g)?2HI(g)△H<0的v-t关系,其中t1时刻改变的条件为升高温度 | B、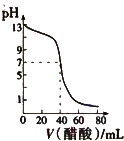 表示:25℃时,用醋酸溶液滴定40.00mL 0.1000mol?L-1 NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol?L-1 | C、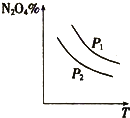 表示:反应2NO2(g)?N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2 | D、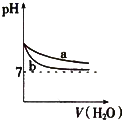 表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水 |
分析:A、若升高温度,正逆反应速率应该同时增大,而图象中t1时刻逆反应速率增大,正反应速率不变,与实际情况不相符,应该为增大了生成物浓度;
B、醋酸为弱电解质,当向40.00mL 0.1000mol?L-1 NaOH溶液中进入40.00mL 0.1000mol?L-1的醋酸时,二者恰好反应生成醋酸钠,醋酸根离子水解,溶液显示碱性,而不是pH=7;
C、根据图象可知,压强相同时,升高温度N2O4的含量减小,说明升高温度,平衡向着逆向移动,说明该反应为放热反应;温度相同时,增大压强,平衡向着正向移动,N2O4的含量增大,所以P1>P2;
D、氨水为弱碱,稀释过程中一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,溶液的pH变化较小,即加入相同体积的蒸馏水时,氨水的pH始终大于氢氧化钠溶液的pH;当加入较大体积的蒸馏水时,溶液的pH只能无限接近7,但是不可能出现pH≤7.
B、醋酸为弱电解质,当向40.00mL 0.1000mol?L-1 NaOH溶液中进入40.00mL 0.1000mol?L-1的醋酸时,二者恰好反应生成醋酸钠,醋酸根离子水解,溶液显示碱性,而不是pH=7;
C、根据图象可知,压强相同时,升高温度N2O4的含量减小,说明升高温度,平衡向着逆向移动,说明该反应为放热反应;温度相同时,增大压强,平衡向着正向移动,N2O4的含量增大,所以P1>P2;
D、氨水为弱碱,稀释过程中一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,溶液的pH变化较小,即加入相同体积的蒸馏水时,氨水的pH始终大于氢氧化钠溶液的pH;当加入较大体积的蒸馏水时,溶液的pH只能无限接近7,但是不可能出现pH≤7.
解答:解:A、根据图象可知,t1时刻逆反应速率增大,正反应速率不变,说明是增大了生成物浓度,若是升高了温度,正逆反应速率会同时增大,故A错误;
B、由于醋酸为弱酸,当滴入等体积、等浓度的醋酸时,氢氧化钠与醋酸恰好反应生成强碱弱酸盐醋酸钠,溶液显示碱性,而图象中溶液的pH=7是不合理的,故B错误;
C、该反应为体积缩小的反应,温度相同时,增大压强,平衡向着正向移动,N2O4的含量增大,所以P1>P2; 根据图象分析:压强相同时,升高温度后N2O4的含量减小,说明平衡向着逆向移动,该反应为放热反应,△H<0,所以正确关系为:△H<0、P1>P2,故C错误;
D、一水合氨为弱碱,氢氧化钠为强碱,稀释过程中一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,所以溶液的pH变化较小,在加入相同体积的蒸馏水时,氨水的pH始终大于氢氧化钠溶液的pH;当加入较大体积的蒸馏水时,溶液的pH会无限接近7,但不可能出现pH≤7,图象数据与实际情况相符合,故D正确;
故选D.
B、由于醋酸为弱酸,当滴入等体积、等浓度的醋酸时,氢氧化钠与醋酸恰好反应生成强碱弱酸盐醋酸钠,溶液显示碱性,而图象中溶液的pH=7是不合理的,故B错误;
C、该反应为体积缩小的反应,温度相同时,增大压强,平衡向着正向移动,N2O4的含量增大,所以P1>P2; 根据图象分析:压强相同时,升高温度后N2O4的含量减小,说明平衡向着逆向移动,该反应为放热反应,△H<0,所以正确关系为:△H<0、P1>P2,故C错误;
D、一水合氨为弱碱,氢氧化钠为强碱,稀释过程中一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,所以溶液的pH变化较小,在加入相同体积的蒸馏水时,氨水的pH始终大于氢氧化钠溶液的pH;当加入较大体积的蒸馏水时,溶液的pH会无限接近7,但不可能出现pH≤7,图象数据与实际情况相符合,故D正确;
故选D.
点评:本题考查了化学反应速率与化学平衡图象的综合应用、中和滴定曲线、弱电解质的电离平衡、体积百分含量随温度、压强的变化,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况,选项B、D为易错点,注意醋酸与氢氧化钠恰好反应时溶液为碱性、碱溶液稀释过程中不可能变成中性或者酸性.

练习册系列答案
相关题目





