题目内容
某温度时,测得 0.01mol?L-1氢氧化钠溶液的 pH=11.
(1)则该温度下水的离子积(Kw)=
(2)在此温度下该溶液中由水电离出的 H十的物质的量浓度为 mol?L-1
(3)在此温度下,将 p=a的氢氧化钠溶液VaL 与 pH=b 的 H2SO4溶液VbL 混合,若所得溶液为中性,且a=12,b=2,则 Va:Vb= .
(1)则该温度下水的离子积(Kw)=
(2)在此温度下该溶液中由水电离出的 H十的物质的量浓度为
(3)在此温度下,将 p=a的氢氧化钠溶液VaL 与 pH=b 的 H2SO4溶液VbL 混合,若所得溶液为中性,且a=12,b=2,则 Va:Vb=
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)根据溶液的pH计算溶液中氢离子浓度,根据氢氧化钠的浓度计算氢氧根离子浓度,再结合Kw=c(H+).c(OH-)计算Kw;
(2)在碱溶液中,H+完全来自于水的电离;
(3)根据混合后显中性,即n(H+)=n(OH-)来计算.
(2)在碱溶液中,H+完全来自于水的电离;
(3)根据混合后显中性,即n(H+)=n(OH-)来计算.
解答:
解:(1)0.01mol?L-1的NaOH溶液的pH为11,则c(H+)=10-11 mol/L,氢氧化钠是强电解质完全电离,所以溶液中氢氧根离子浓度是0.01mol/L,则Kw=c(H+).c(OH-)=0.01×10-11=10-13,
故答案为:10-13mol2/L2;
(2)在碱溶液中,H+完全来自于水的电离,而在该溶液中,c(H+)=10-11 mol/L,故由水电离出的H+浓度c(H+)=10-11 mol/L,故答案为:10-11;
(3)在此温度下,水的离子积(Kw)=10-13,PH=a的氢氧化钠溶液中c(OH-)=10a-13mol/L,pH=b 的 H2SO4溶液中c(H+)=10-b mol/L,根据混合后显中性即n(H+)=n(OH-)可有:10a-13mol/L×VaL=10-b mol/L×VbL ①
又已知 a=12,b=2 ②
由①②可知,Va:Vb=1:10,故答案为:1:10
故答案为:10-13mol2/L2;
(2)在碱溶液中,H+完全来自于水的电离,而在该溶液中,c(H+)=10-11 mol/L,故由水电离出的H+浓度c(H+)=10-11 mol/L,故答案为:10-11;
(3)在此温度下,水的离子积(Kw)=10-13,PH=a的氢氧化钠溶液中c(OH-)=10a-13mol/L,pH=b 的 H2SO4溶液中c(H+)=10-b mol/L,根据混合后显中性即n(H+)=n(OH-)可有:10a-13mol/L×VaL=10-b mol/L×VbL ①
又已知 a=12,b=2 ②
由①②可知,Va:Vb=1:10,故答案为:1:10
点评:本题考查溶液混合后pH的计算以及水的离子积常数有关计算,侧重考查学生对知识的迁移和应用,难度中等.

练习册系列答案
相关题目
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、一定温度下,pH=6的纯水中含有OH-的数目为10-6 NA |
| B、120 g NaHSO4固体中含有的离子总数为2NA |
| C、1L0.1mol?L-1氨水含有0.1NA个OH- |
| D、1mol甲醇中含有C-H键的数目为4NA |
下列有机反应方程式书写正确的是( )
A、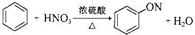 | |||
| B、H2C=CH2+Br2→CH3CHBr2 | |||
C、CH3COOH+CH3CH2OH
| |||
D、CH4+2O2
|
mg铜和足量硝酸溶液反应,生成VL气体(标准状况),则反应中发生转移的电子的物质的量最接近于( )
A、
| ||
B、
| ||
C、
| ||
D、
|
利尿酸在奥运会上被禁用,其结构简式如图所示.下列叙述正确的是( )


| A、利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4 |
| B、利尿酸分子与足量消耗氢氧化钠反应最多3mol |
| C、1 mol利尿酸能与7 mol H2发生加成反应 |
| D、利尿酸能与FeCl3溶液发生显色反应 |
钠与水反应的离子方程式正确的是( )
| A、2Na+3H+═2Na++H2↑ |
| B、Na+H2O═Na++OH-+H2↑ |
| C、2Na+2H2O═2Na++2OH-+H2↑ |
| D、2Na+2H2O═2Na++O2↑+2H2↑ |
用坩埚钳夹住一片刚刚用盐酸处理过的铝箔,在酒精灯上加热至熔化,可观察到熔化的铝并不滴落.对此现象解释不正确的是( )
| A、铝在空气中能很快形成氧化膜 |
| B、氧化膜的熔点比铝高 |
| C、氧化膜与盐酸不反应 |
| D、外焰温度未达到氧化膜的熔点 |
