题目内容
9.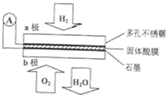 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1 mol电子,标准状况下需消耗1.12L的H2 |
分析 根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,标准状况下的体积为1.12L,由此分析解答.
解答 解:A、因氢元素的化合价升高,则a为负极,这样电子应该是通过外电路由a极流向b,故A正确;
B、该电池为酸性电池,反应为O2+4e-+4H+=2H2O,故B正确;
C、原电池中,a极氢气失电子生成H+,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故C错误;
D、每转移0.1mol电子,消耗0.05mol的H2,标准状况下的体积为1.12L,故D正确.
故选C.
点评 本题考查燃料电池的工作原理,学习中要明确电子以及离子的定向移动问题,要能正确判断原电池的正负极,以及电极反应式的书写问题.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
5.实现下列变化既不需要另加入还原剂,也不需要另加入氧化剂的是( )
| A. | F2→F- | B. | HNO3→NO | C. | Mg→Mg2+ | D. | Na2O2→O2 |
20. 在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
 在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )| A. | P3>P4,Y轴表示混合气体的平均摩尔质量 | |
| B. | P3>P4,Y轴表示混合气体的密度 | |
| C. | P3<P4,Y轴表示A2的浓度 | |
| D. | P3<P4,Y轴表示A2的转化率 |
17.下表列出了前20号元素中的某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中第一电离能最小的是K(填元素符号).
(2)写出下列有关反应的化学方程式:E的单质与I元素的最高价氧化物对应的水化物反应:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)比元素B原子序数大11的元素的基态原子电子排布式是[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是N(填元素符号),可以验证你的结论的是下列中的ab(填编号).
a.气态氢化物的稳定性
b.两元素的电负性
c.含氧酸的酸性
d.最高化合价.
| 元素编号 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高正价 | +6 | +1 | 无 | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低负价 | -2 | 无 | -2 | 无 | -4 | -3 | -1 | 无 | -3 | -4 |
(1)以上10种元素中第一电离能最小的是K(填元素符号).
(2)写出下列有关反应的化学方程式:E的单质与I元素的最高价氧化物对应的水化物反应:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)比元素B原子序数大11的元素的基态原子电子排布式是[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是N(填元素符号),可以验证你的结论的是下列中的ab(填编号).
a.气态氢化物的稳定性
b.两元素的电负性
c.含氧酸的酸性
d.最高化合价.
4.针对下面10种元素,完成以下各小题.
(1)常温下,会在浓硫酸中发生钝化的金属是铝(填名称).
(2)化学性质最不活泼的元素是Ne(填元素符号).
(3)镁的原子结构示意图为 .
.
(4)C与N相比,原子半径较小的是N.
(5)最高价氧化物对应的水化物酸性最强的是HClO4碱性最强的是NaOH(填化学式).
(6)常用于制半导体材料的元素是硅.
(7)H2S和HCl相比,热稳定性较强的是HCl.
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2,其中硫元素和氧元素的质量比m(S):m(O)=1:1.
(9)常温下金属钠能与水激烈反应,请写出反应的化学方程式:2Na+2H2O=2NaOH+H2↑.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)化学性质最不活泼的元素是Ne(填元素符号).
(3)镁的原子结构示意图为
 .
.(4)C与N相比,原子半径较小的是N.
(5)最高价氧化物对应的水化物酸性最强的是HClO4碱性最强的是NaOH(填化学式).
(6)常用于制半导体材料的元素是硅.
(7)H2S和HCl相比,热稳定性较强的是HCl.
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2,其中硫元素和氧元素的质量比m(S):m(O)=1:1.
(9)常温下金属钠能与水激烈反应,请写出反应的化学方程式:2Na+2H2O=2NaOH+H2↑.
14.下列表示物质结构的化学用语或模型正确的是( )
| A. | HF的电子式: | |
| B. | 二氧化碳的结构式:O=C=O | |
| C. | Cl-离子的结构示意图: | |
| D. | 质子数为6,中子数为8的微粒:${\;}_{6}^{8}$C |
1.下列物质中:互为同分异构体的是( )
| A. | 液氯、氯气 | B. | CH2=CH-CH3 CH3-CH2-CH3 | ||
| C. | N2、CO | D. | 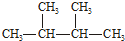 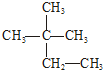 |
18.以下转化不能通过一步反应实现的是( )
| A. | SiO2→SiF4 | B. | Al2O3→Al(OH)3 | C. | Fe→FeCl2 | D. | SiO2→CaSiO3 |
19.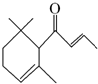 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 1 mol该化合物完全燃烧消耗19 mol O2 | |
| D. | 与足量溴水加成,最多消耗Br22 mol |