题目内容
(1)写出下列物质的电离方程式.H2CO3: ,NH4HSO4: .
(2)有相同体积物质的量浓度都是1.0mol?L-1的硫酸、盐酸和醋酸三种溶液,设它们的pH值分别为a,b,c.按由大到小的顺序排列: .
(3)将质量相同的铁粉分别放入pH值相同的三杯溶液中,它们分别为硫酸,醋酸,盐酸.刚开始时三者的速率分别记为υ1,υ2,υ3,则三者大小关系为: .若三种酸溶液的量都足量,铁粉在三种溶液中溶解所消耗的时间分别记为t1,t2,t3.则三者之间的大小关系为: .
(4)电离常数K表示电解质电离的能力,K愈小,表示电离程度愈 (填大或小). K随温度升高而 (填增大或减小),原因是: .
(2)有相同体积物质的量浓度都是1.0mol?L-1的硫酸、盐酸和醋酸三种溶液,设它们的pH值分别为a,b,c.按由大到小的顺序排列:
(3)将质量相同的铁粉分别放入pH值相同的三杯溶液中,它们分别为硫酸,醋酸,盐酸.刚开始时三者的速率分别记为υ1,υ2,υ3,则三者大小关系为:
(4)电离常数K表示电解质电离的能力,K愈小,表示电离程度愈
分析:(1)碳酸是多元弱酸,电离方程式只写第一步的;硫酸氢铵是强电解质,完全电离;
(2)硫酸是二元强酸,盐酸是一元强酸,醋酸是弱酸;
(3)pH相同,醋酸是弱电解质,部分电离,所以醋酸的浓度最大;盐酸和硫酸都是强酸,溶液中氢离子浓度相等,据此进行分析即可;
(4)电离常数越小,电离程度越小;温度升高,电离常数增大,因为电离过程是吸热过程.
(2)硫酸是二元强酸,盐酸是一元强酸,醋酸是弱酸;
(3)pH相同,醋酸是弱电解质,部分电离,所以醋酸的浓度最大;盐酸和硫酸都是强酸,溶液中氢离子浓度相等,据此进行分析即可;
(4)电离常数越小,电离程度越小;温度升高,电离常数增大,因为电离过程是吸热过程.
解答:解:(1)由于碳酸是多元弱酸,电离方程式只写第一步,碳酸电离方程式为:H2CO3?H++HCO3-;硫酸是强电解质,溶液中硫酸氢根离子写成氢离子和硫酸根离子形式,硫酸氢铵的电离方程式为:NH4HSO4 =NH4++H++SO42-,
故答案为:H2CO3?H++HCO3-;NH4HSO4 =NH4++H++SO42-;
(2)由于硫酸是二元强酸,氢离子浓度为0.2mol/L;盐酸是一元强酸,氢离子浓度为0.mol/L;醋酸是弱酸,氢离子浓度小于0.mol/L,氢离子浓度越大,溶液的PH越小,所以abc的关系为:c>b>a,
故答案为:c>b>a;
(3)由于PH相同,醋酸是弱电解质部分电离,所以醋酸的浓度最大;盐酸和硫酸都是强酸,溶液中氢离子浓度相等,刚开始时三种溶液中氢离子浓度相等,所以反应速率相同,即υ1=υ2=υ3;由于酸过量,醋酸溶液中不断电离出氢离子,溶液中氢离子浓度大于盐酸和硫酸的氢离子浓度,所以反应速率快,消耗的时间短,硫酸与盐酸消耗的时间相同,即t1=t3 >t2,
故答案为:υ1=υ2=υ3;t1=t3 >t2;
(4)电离常数K表示电解质电离的能力,K愈小,电离程度越小;温度升高,由于电离过程是吸热过程,所以电离常数增大,
故答案为:小;增大;电离过程是吸热的,升高温度促使平衡向着正向移动.
故答案为:H2CO3?H++HCO3-;NH4HSO4 =NH4++H++SO42-;
(2)由于硫酸是二元强酸,氢离子浓度为0.2mol/L;盐酸是一元强酸,氢离子浓度为0.mol/L;醋酸是弱酸,氢离子浓度小于0.mol/L,氢离子浓度越大,溶液的PH越小,所以abc的关系为:c>b>a,
故答案为:c>b>a;
(3)由于PH相同,醋酸是弱电解质部分电离,所以醋酸的浓度最大;盐酸和硫酸都是强酸,溶液中氢离子浓度相等,刚开始时三种溶液中氢离子浓度相等,所以反应速率相同,即υ1=υ2=υ3;由于酸过量,醋酸溶液中不断电离出氢离子,溶液中氢离子浓度大于盐酸和硫酸的氢离子浓度,所以反应速率快,消耗的时间短,硫酸与盐酸消耗的时间相同,即t1=t3 >t2,
故答案为:υ1=υ2=υ3;t1=t3 >t2;
(4)电离常数K表示电解质电离的能力,K愈小,电离程度越小;温度升高,由于电离过程是吸热过程,所以电离常数增大,
故答案为:小;增大;电离过程是吸热的,升高温度促使平衡向着正向移动.
点评:本题考查了电离方程式的书写及电离程度大小比较,涉及的内容较多,根据所学知识完成即可,本题难度不大.

练习册系列答案
相关题目
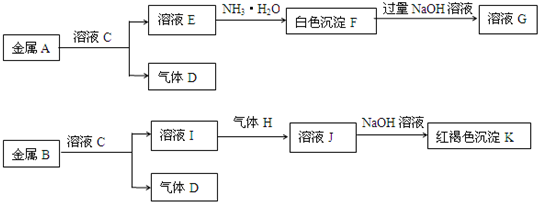
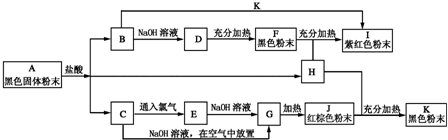
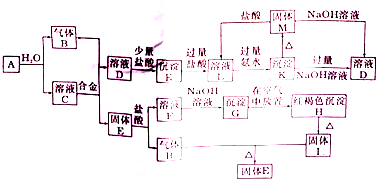
 如图是六种物质的相互转化关系.已知E是固态单质,常见于火山口处,六种物质中均含有构成E的元素.
如图是六种物质的相互转化关系.已知E是固态单质,常见于火山口处,六种物质中均含有构成E的元素.