题目内容
【题目】研究NO、NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)与氮氧化物有关的全球或区域性大气环境问题有_______(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾 d.白色污染
(2)NO2可与水发生反应,反应的化学方程式为___________。若该反应有0.6NA个电子转移,则参加反应的NO2的物质的量为___________。
(3)NH3也是重要的含氮化合物,实验室用NH4Cl和Ca(OH)2制取NH3。
①写出反应的化学方程式_________________
②若用下图所示装置收集氨气,气体由_____口进入。

(4)硝酸可与不活泼金属铜发生反应。将过量的铜置入一定量的浓硝酸中,微热,充分反应后,待反应停止,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是(用离子方程式解释)_____________________
(5)若将12.8 g铜跟一定质量的浓硝酸反应,铜耗完时,共产生气体5.6 L(标准状况),则整个反应过程中,被还原的HNO3总的物质的量是___________mol。
【答案】ac 3NO2+H2O=2HNO3+NO 0.9mol 2NH4Cl +Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O A 3Cu+8H+ + 2NO3— =3Cu2+ + 2NO↑+ 4H2O 0.25mol
CaCl2 + 2NH3↑+2H2O A 3Cu+8H+ + 2NO3— =3Cu2+ + 2NO↑+ 4H2O 0.25mol
【解析】
二氧化氮与水反应产生硝酸,3molNO2反应转移2mol电子;实验室用氯化铵和氢氧化钙制取氨气,氨气密度小于空气,选用向下排空气法;铜不与硫酸反应,过量的铜屑与稀硝酸作用,反应停止后,再加入稀硫酸,溶液中的硝酸根离子在酸性溶液中具有强氧化性,能继续溶解铜,铜屑又逐渐溶解。
(1)
a.酸雨,主要因素是硫化物和氮氧化物,A错误;
b.沙尘暴,主要因素是灰尘和沙粒,B错误;
c.光化学烟雾,主要是碳氢化合物和氮氧化物等一次污染物,C错误;
d.白色污染,主要是塑料制品,D错误;
综上,AC正确;
(2)NO2可与水发生反应,3NO2+H2O=2HNO3+NO,3mol二氧化氮转移2mol电子,故该反应有0.6NA个电子转移,则参加反应的NO2的物质的量为0.9mol;
(3)
①NH4Cl和Ca(OH)2制取NH3 ,2NH4Cl +Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O;
CaCl2 + 2NH3↑+2H2O;
②氨气密度小于空气,气体由短口进入,即A口;
(4)铜不与硫酸反应,过量的铜屑与稀硝酸作用,反应停止后,再加入稀硫酸,溶液中的硝酸根离子在酸性溶液中具有强氧化性,能继续溶解铜,铜屑又逐渐溶解。涉及反应为3Cu+8H+ + 2NO3-=3Cu2++2NO↑+4H2O;
(5)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,硝酸浓度变小后又可以生成NO。若将12.8 g铜即0.2mol,跟浓硝酸反应共产生气体5.6 L(标准状况),气体的物质的量为0.25mol,在整个反应过程中,被还原的HNO3转化为二氧化氮或二氧化氮与一氧化氮的混合物,根据氮元素守恒可知,被还原的硝酸的物质的量就是0.25mol。

 名校课堂系列答案
名校课堂系列答案【题目】叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |

(1)制备NaN3:
30℃时,水合肼(N2H4H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2)测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I- ![]() I2
I2 ![]() S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________
【题目】NH3 是一种重要的化工原料,工业上用 H2、N2合成。
(1)工业上由焦炭或天然气制氢气的过程中会产生一氧化碳。为了尽量除去氢气中混有的 一氧化碳,可在催化剂存在的条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
①在一个容积为 2L 的恒温密闭容器中加入 1molCO 和 3molH2O(g),发生上述反应,5min 后达到平衡,测得放出热量为 20.5kJ,则该时间段内反应的平均速率ν(CO)=______,此温度下该反应平衡常数 K=_____。该温度下在此容器中加入 3molCO 和 1molH2O(g)发生上述反应,达到平衡后放出热 量_____20.5kJ(填“>”、“=”或“<”)。
②已知不同反应物投料比(![]() )下,平衡混合气体中 CO 的体积分数如下表所示:
)下,平衡混合气体中 CO 的体积分数如下表所示:
温度(℃)\投料比 | 1 | 3 | 5 |
200℃ | 0.70 | 0.21 | 0.02 |
从表中数据分析可知:
反应物投料比越大,CO 的平衡转化率越________(填“大”或“小”); 请推测随反应物投料比增大,H2O的平衡转化率的变化趋势是______(填字母)。
A.增大 B.减小 C.先减小后增大 D.先增大后减小
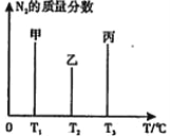
(2)用 2mol N2和3molH2合成氨,三容器的反应温度分别为 T1、T2、T3且恒定不变,在 其它条件相同的情况下,实验测得反应均进行到t min时N2的质量分数如图所示,此时甲、乙、丙三个容器中一定达到化学平衡状态的是_____,都达到平衡状态时,N2转化率最低的是________。(用“甲”、“乙”、“丙”填空)
(3)NH3与CO2在120℃,催化剂作用下可以合成反应生成尿素: CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
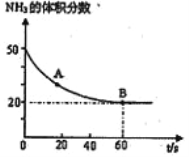
A 点的逆反应速率V逆(CO2)_____B 点的正反应速率 V正(CO2)(填“>”、 “=”或“<”);NH3的平衡转化率为____________。
(4)已知 NH2COONH4(s)![]() 2NH3(g)+CO2(g),若将一量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1____________P2, ρ1_____________________ρ2(填“>”、“=”或“<”)。
2NH3(g)+CO2(g),若将一量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1____________P2, ρ1_____________________ρ2(填“>”、“=”或“<”)。