题目内容
光气(COCl2)的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H=+108kJ?mol-1.反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14min的COCl2浓度变化未标出):
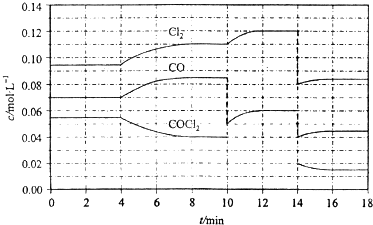
下列说法正确的是( )

下列说法正确的是( )
| A、COCl2在5~6 min和15~16 min时平均反应速率:v(5~6)>v(15~16) | B、第10 min时,改变反应条件,反应重新达到平衡前:v(正)<v(逆) | C、第12 min时,反应重新达到平衡,c(COCl2)≈0.03 mol?L-1 | D、第14 min时,改变的条件是减小压强,随着平衡的移动,COCl2的转化率减小 |
分析:A、根据图象中COCl2在5~6 min时浓度比15~16 min时浓度大,据此判断;
B、由图可知,10min时CO浓度突然减小,Cl2没变,改变条件是减少CO浓度;
C、根据Cl2增大的浓度值,求出COCl2减小的浓度值,然后求出平衡浓度;
D、14min时改变条件,是增大体积,降低压强,平衡向正反应移动.
B、由图可知,10min时CO浓度突然减小,Cl2没变,改变条件是减少CO浓度;
C、根据Cl2增大的浓度值,求出COCl2减小的浓度值,然后求出平衡浓度;
D、14min时改变条件,是增大体积,降低压强,平衡向正反应移动.
解答:解:A、根据图象中COCl2在5~6 min时浓度比15~16 min时浓度大,浓度越大速率越快,所以COCl2在5~6 min和15~16 min时平均反应速率:v(5~6)>v(15~16),故A正确;
B、由图可知,10min时CO浓度突然减小,Cl2没变,改变条件是减少CO浓度,减少生成物的浓度平衡正移,所以v(正)>v(逆),故B错误;
C、由图可知10min~12 min时,Cl2增大了0.12-0.11=0.01 mol?L-1,所以消耗的COCl2为0.01 mol?L-1,已知10min时COCl2为0.04 mol?L-1,所以第12 min时,c(COCl2)≈0.03 mol?L-1;故C正确;
D、14min时改变条件,是增大体积,降低压强,平衡向正反应移动,所以COCl2的转化率增大,故D错误;
故选AC.
B、由图可知,10min时CO浓度突然减小,Cl2没变,改变条件是减少CO浓度,减少生成物的浓度平衡正移,所以v(正)>v(逆),故B错误;
C、由图可知10min~12 min时,Cl2增大了0.12-0.11=0.01 mol?L-1,所以消耗的COCl2为0.01 mol?L-1,已知10min时COCl2为0.04 mol?L-1,所以第12 min时,c(COCl2)≈0.03 mol?L-1;故C正确;
D、14min时改变条件,是增大体积,降低压强,平衡向正反应移动,所以COCl2的转化率增大,故D错误;
故选AC.
点评:本题考查化学平衡图象、平衡常数、化学平衡与反应速率的影响因素,题目难度中等,根据平衡常数与改变条件的瞬间各物质的浓度变化判断条件是解题的关键.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
氯仿(CHCl3)是甲烷与氯气在光照条件下发生取代反应的产物之一,氯仿可作为局部麻醉剂,常因保持不慎而被空气氧化,产生剧毒气体--光气(COCl2).2CHCl3+O2→2COCl2+2HCl,为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是( )
| A、NaOH(aq) | B、AgNO3(aq) | C、HCl(aq) | D、湿润的无色酚酞试纸 |
光气(COCl2)的分解反应为:COCl2(g) Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
下列说法正确的是
| A.COCl2在5~6 min和15~16 min时平均反应速率:v(5~6)< v(15~16) |
| B.第10 min时,改变反应条件,反应重新达到平衡前:v(正)>v(逆) |
| C.第12 min时,反应重新达到平衡,c(COCl2)≈ 0.03 mol·L-1 |
| D.第14 min时,改变的条件是减小压强,随着平衡的移动,COCl2的转化率减小 |
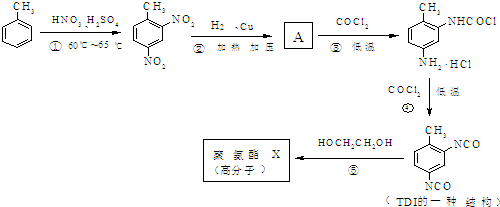
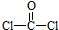
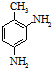
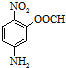
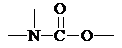 结构.第⑤步反应类型为
结构.第⑤步反应类型为


 Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):