题目内容
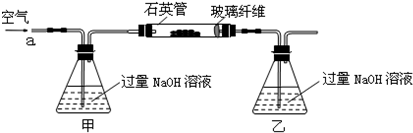
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。

实验操作和现象

⑴A中反应的化学方程式是_______________。
⑵C中白色沉淀是__________,该沉淀的生成表明SO2具有____________性。
⑶C中液面上方生成浅棕色气体的化学方程式是____________________________。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是______________;乙在A、B间增加洗气瓶D,D中盛放的试剂是______________。
②进行实验,B中现象
⑵C中白色沉淀是__________,该沉淀的生成表明SO2具有____________性。
⑶C中液面上方生成浅棕色气体的化学方程式是____________________________。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是______________;乙在A、B间增加洗气瓶D,D中盛放的试剂是______________。
②进行实验,B中现象

检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:______________。
⑸合并⑷中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是____________________________。
⑸合并⑷中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是____________________________。
⑴Cu+2H2SO4 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
⑵H2SO4;还原
⑶2NO+O2==2NO2
⑷①通N2一段时间,排除装置中的空气;饱和NaHSO3溶液;②甲:SO42-+Ba2+==BaSO4↓,
乙:2Ba2++2SO2+O2+2H2O==2BaSO4↓+4H+,白雾的量远多于装置中O2的量
⑸SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O⑵H2SO4;还原
⑶2NO+O2==2NO2
⑷①通N2一段时间,排除装置中的空气;饱和NaHSO3溶液;②甲:SO42-+Ba2+==BaSO4↓,
乙:2Ba2++2SO2+O2+2H2O==2BaSO4↓+4H+,白雾的量远多于装置中O2的量
⑸SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀

练习册系列答案
相关题目
黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对该黄铁矿石进行如下实验探究.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全.其反应的化学方程式为:
4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
4FeS+7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
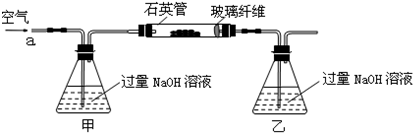
实验一:测定硫元素的含量
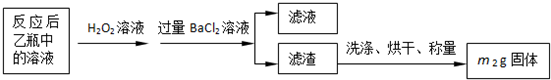
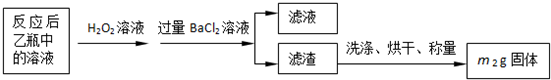
反应结束后,将乙瓶中的溶液进行如下处理:
(1)甲、乙两装置的作用分别是______、______;
乙瓶内发生反应的离子方程式为______、______;
(2)反应后乙瓶中的溶液需加足量H2O2溶液的目的是______.
(3)该黄铁矿石中硫元素的质量分数为______.
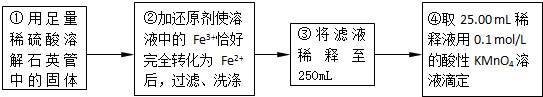
实验二:测定铁元素的含量
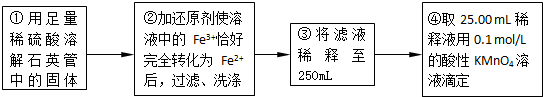
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量______(填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有______.
(6)某同学一共进行了三次滴定实验,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
其他条件不变时:探究浓度对化学反应速率的影响,应选择______(填实验编号);
探究温度对化学反应速率的影响,应选择______(填实验编号).
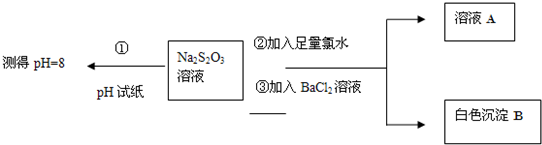
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是______.
甲同学设计如下实验流程探究Na2S2O3的化学性质.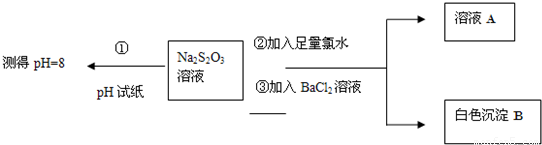
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和______性.
(Ⅱ)生成白色沉淀B的离子方程式是______.
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是______(填“甲”或“乙”),理由是______.
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
探究温度对化学反应速率的影响,应选择______(填实验编号).
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是______.
甲同学设计如下实验流程探究Na2S2O3的化学性质.

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和______性.
(Ⅱ)生成白色沉淀B的离子方程式是______.
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是______(填“甲”或“乙”),理由是______.