题目内容
设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下11.2L Cl2溶于1L水中,转移电子的数目为0.5NA
B.将标准状况下22.4L NO与11.2L O2混合后的体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA
D.O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA
D
【解析】
试题分析:A、标准状况下11.2L的氯气的物质的量是0.5mol,与水的反应是可逆反应,所以转移的电子数小于0.5NA,错误;B、NO与氧气反应生成二氧化氮,同时二氧化氮与四氧化二氮之间存在平衡,所以标准状况下22.4L NO与11.2L O2混合后的体积小于22.4L,错误;C、根据化学方程式可知,氯气既是氧化产物,又是还原产物,所以生成0.4mol氯气时消耗0.1mol KClO4,Cl元素的化合价有+7价降为0价,转移电子数是0.7NA,错误;D、氧气与臭氧的组成元素都是O元素,所以6.4g二者的混合气体中O原子的物质的量是6.4g/16g/mol=0.4mol,则O原子数是0.4NA,正确,答案选D。
考点:考查阿伏伽德罗常数的应用

(每个方程式2分,其余每空1分,共8分)现有下列物质:
①KI ②铜 ③稀硝酸 ④NH3 ⑤NaHSO4 ⑥Ba(OH)2 ⑦氢氧化铁胶体 ⑧氨水
(1)按物质的分类方法填写表格的空白处(填物质编号)
分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
属于该类的物质 |
|
|
|
|
(2)上述某两种物质在溶液中可发生离子反应:H++OH-= H2O,写出该离子反应对应的化学方程式 。
(3)物质①的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为 。
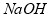 的工艺流程示意图如下:
的工艺流程示意图如下: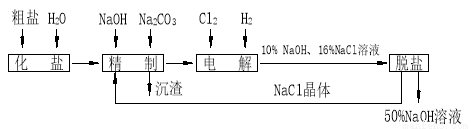
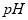 值___________。(选填:不变、升高或下降)
值___________。(选填:不变、升高或下降)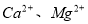 等杂质,精制过程发生反应的离子方程式为____________________________________________;
等杂质,精制过程发生反应的离子方程式为____________________________________________;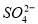 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去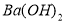 b.
b. 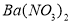 c.
c. 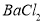
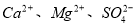 ,加入试剂的合理顺序为_____________(选填a、b、c多选倒扣分)
,加入试剂的合理顺序为_____________(选填a、b、c多选倒扣分)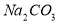 ,再加钡试剂
,再加钡试剂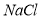 在溶解度上的差异,通过____________、冷却、______________(填写操作名称)除去
在溶解度上的差异,通过____________、冷却、______________(填写操作名称)除去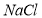 。
。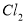 与
与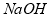 反应;采用无隔膜电解冷的食盐水时,
反应;采用无隔膜电解冷的食盐水时,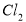 与
与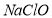 和
和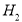 ,相应的化学方程式为_____________________。
,相应的化学方程式为_____________________。
 O2(g)=== ZnO (s) △H= - Q1 kJ? mol-1 ①
O2(g)=== ZnO (s) △H= - Q1 kJ? mol-1 ① O2
O2 CH3COO一+ H+,对于该平衡,下列叙述不正确的是
CH3COO一+ H+,对于该平衡,下列叙述不正确的是