题目内容
19.不饱和酯类化合物在药物、涂料等方面应用广泛.(1)反应①是一种由烯烃直接制备不饱和酯的新方法:
①
 1mol化合物Ⅰ能与4molH2发生完全加成反应
1mol化合物Ⅰ能与4molH2发生完全加成反应(2)化合物I可由芳香族化合物Ⅱ或Ⅲ分别通过消去反应获得,但只有Ⅱ能与Na反应产生H2,II的结构简式可能为
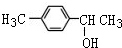 或
或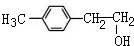 (写1种即可);由Ⅲ生成Ⅰ的反应条件为NaOH的乙醇溶液,加热.
(写1种即可);由Ⅲ生成Ⅰ的反应条件为NaOH的乙醇溶液,加热.(3)聚合物
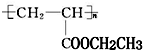 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3;利用类似反应①的方法,以乙烯和乙醇为有机物原料合成该单体,该反应的化学方程式为2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3;利用类似反应①的方法,以乙烯和乙醇为有机物原料合成该单体,该反应的化学方程式为2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.
分析 (1)能和氢气发生加成反应的有苯环和碳碳双键;
(2)化合物I可由芳香族化合物Ⅱ或Ⅲ分别通过消去反应获得,但只有Ⅱ能与Na反应产生H2,说明Ⅱ中含有醇羟基,醇羟基可位于碳碳双键两端的任一个C原子上;Ⅲ是卤代烃,卤代烃和氢氧化钠的醇溶液发生消去反应;
(3)聚合物 可用于制备涂料,其单体为丙烯酸乙酯,利用类似反应由烯烃制备不饱和酯的方法,仅以乙烯为有机物原料合成该单体,醇为乙醇,根据反应由烯烃制备不饱和酯书写反应方程式.
可用于制备涂料,其单体为丙烯酸乙酯,利用类似反应由烯烃制备不饱和酯的方法,仅以乙烯为有机物原料合成该单体,醇为乙醇,根据反应由烯烃制备不饱和酯书写反应方程式.
解答 解:(1)能和氢气发生加成反应的有苯环和碳碳双键,1mol化合物I能与4mol H2恰好完全反应生成饱和烃类化合物,
故答案为:4;
(2)化合物I可由芳香族化合物Ⅱ或Ⅲ分别通过消去反应获得,但只有Ⅱ能与Na反应产生H2,说明Ⅱ中含有醇羟基,醇羟基可位于碳碳双键两端的任一个C原子上,其结构简式为 或
或 ;Ⅲ是卤代烃,卤代烃和氢氧化钠的醇溶液发生消去反应,所以其反应条件是氢氧化钠的醇溶液、加热;
;Ⅲ是卤代烃,卤代烃和氢氧化钠的醇溶液发生消去反应,所以其反应条件是氢氧化钠的醇溶液、加热;
故答案为: 或
或 ;NaOH的乙醇溶液,加热;
;NaOH的乙醇溶液,加热;
(3)聚合物 可用于制备涂料,其单体为丙烯酸乙酯,结构简式为CH2=CHCOOCH2CH3,利用类似反应由烯烃制备不饱和酯的方法,仅以乙烯为有机物原料合成该单体,醇为乙醇,根据反应由烯烃制备不饱和酯书写反应方程式,该反应方程式为:2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O,
可用于制备涂料,其单体为丙烯酸乙酯,结构简式为CH2=CHCOOCH2CH3,利用类似反应由烯烃制备不饱和酯的方法,仅以乙烯为有机物原料合成该单体,醇为乙醇,根据反应由烯烃制备不饱和酯书写反应方程式,该反应方程式为:2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O,
故答案为:CH2=CHCOOCH2CH3;2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.
点评 本题考查了有机物的官能团及其性质,知道常见有机物官能团及其性质是解本题关键,知道有机反应中断键、成键方式,并结合题给信息分析解答,题目难度中等.

 计算高手系列答案
计算高手系列答案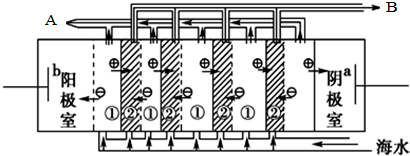 ,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.
,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发 池和结晶池,建盐田必须在BC处建立(填序号).
A.选在离江河入海口比较近的地方
B.多风少雨
C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe2+、SO42-等离子,流程如下:
粗盐水$→_{过程Ⅰ}^{过量BaCl_{2}溶液}$$→_{过程Ⅱ}^{过量Na_{2}CO_{3}溶液}$$→_{过程Ⅲ}^{过量NaOH溶液}$$→_{过程Ⅳ}^{过滤}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20℃部分沉淀的溶解度(g)如表
| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
| A. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 将淀粉在酸性条件下水解后直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 除去苯中的苯酚的方法是:加溴水,振荡,过滤除去沉淀 | |
| D. | 除去混入CH3CH2OH中的蚁酸HCOOH:加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 |
| A. | 由水电离出的c(H )═10-13mol/L 溶液:Mg2+、Cu2+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、NH4+、Cl-、S2- | |
| C. | 高锰酸钾溶液:Fe3+、H+、SO42-、C2H5OH | |
| D. | 中性溶液中:Fe3+、K+、Cl-、SO42- |
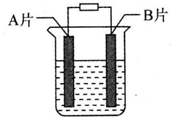 【实验目的】利用所学知识,设计原电池装置.
【实验目的】利用所学知识,设计原电池装置.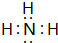 ,请用电子式表示A与C形成化合物的过程
,请用电子式表示A与C形成化合物的过程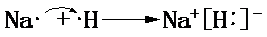 .
.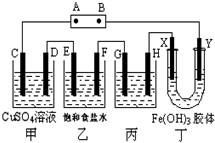 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: